Белки

Белки – высокомолекулярные природные вещества, состоящие из цепочки аминокислот, которые связаны пептидной связью. Важнейшей ролью данных соединений является регуляция химических реакций в организме (ферментативная роль). Помимо этого, они выполняют защитную, гормональную, структурную, питательную, энергетическую функции.
По строению белки подразделяют на простые (протеины) и сложные (протеиды). Количество аминокислотных остатков в молекулах различно: миоглобина – 140, инсулина – 51, что объясняет высокую молекулярную массу соединения (Mr), которая варьируется в диапазоне от 10 000 до 3 000 000 дальтон.
17% от общего веса человека составляют белки: 10% приходится на кожу, 20% – на хрящи, кости, 50% – на мышцы. Несмотря на то, что роль протеинов и протеидов на сегодня досконально не изучена, функционирование нервной системы, способность к росту, размножению организма, протекание обменных процессов на клеточном уровне напрямую связано с деятельностью аминокислот.
История открытия
Процесс изучения белков берет свое начало в XVIII веке, когда группа ученых во главе с французским химиком Антуаном Франсуа де Фуркруа исследовали альбумин, фибрин, глютен. В результате данных работ протеины были обобщены и выделены в отдельный класс.
В 1836 году впервые Мулдером предложена новая модель химического строения белка, основанная на теории радикалов. Она оставалась общепризнанной до 1850 годов. Современное название белка – протеин – соединение получило в 1838 году. А к концу XIX века немецкий ученый А. Коссель сделал сенсационное открытие: он пришел к заключению, что основными структурными элементами «строительных компонентов» выступают аминокислоты. Данную теорию в начале XX века экспериментально доказал немецкий химик Эмиль Фишер.
В 1926 году американский ученый Джеймс Самнер в ходе исследований обнаружил, что вырабатываемый в организме фермент уреаза относится к белкам. Это открытие сделало переворот в мире науки и привело к осознанию, насколько важную роль играют протеины для жизни человека. В 1949 году английский биохимик Фред Сенгер экспериментально вывел аминокислотную последовательность гормона инсулина, чем подтвердил правильность мышления, что белки представляют собой линейные полимеры аминокислот.
В 1960 годах впервые на основании дифракции рентгеновских лучей получены пространственные структуры протеинов на атомарном уровне. Изучение данного высокомолекулярного органического соединения продолжается по сей день.
Структура белков
Основные структурные единицы белков – аминокислоты, состоящие из аминогрупп (NH2) и карбоксильных остатков (СООН). В ряде случаев, азотоводородные радикалы связаны с ионами углерода, от числа и расположения которых зависят специфические характеристики пептидных веществ. При этом позиция углерода по отношению к аминогруппе подчеркивается в названии специальной приставкой: альфа-, бета-, гамма.
Для белков структурными единицами выступают альфа-аминокислоты, поскольку только они при удлинении полипептидной цепи придают протеиновым фрагментам дополнительную устойчивость и прочность. Соединения данного вида встречаются в природе в виде двух форм: L и D (кроме глицина). Элементы первого типа входят в состав протеинов живых организмов, вырабатываемых животными и растениями, а вторые – в структуры пептидов, образующихся путём нерибосомного синтеза в грибах и бактериях.

Строительный материал для белков соединяется между собой полипептидной связью, которая образуется путём связывания одной аминокислоты с карбоксилом другой аминокислоты. Короткие структуры принято называть пептидами или олигопептидами (молекулярный вес 3 400 – 10 000 дальтон), а длинные, состоящие более чем из 50 аминокислот, полипептидами. Чаще всего в состав белковых цепей входит 100 – 400 аминокислотных остатков, а иногда и 1000 – 1500. Протеины за счёт внутримолекулярных взаимодействий образуют специфические пространственные структуры. Их называют конформациями белков.
Различают четыре уровня организации протеинов:
- Первичная – линейная последовательность аминокислотных остатков, соединённых между собой прочной полипептидной связью.
- Вторичная – упорядоченная организация белковых фрагментов в пространстве в спиральную или складчатую конформацию.
- Третичная – способ пространственной укладки спиральной полипептидной цепи, путём свёртывания вторичной структуры в клубок.
- Четвертичная – сборный белок (олигомер), который образуется при взаимодействии нескольких полипептидных цепей третичной структуры.
По форме строения белки разделяют на 3 группы:
- фибриллярные;
- глобулярные;
- мембранные.
Первый тип протеинов – нитевидные молекулы с поперечными связями, формирующие продолжительные волокна или слоистые структуры. Учитывая, что фибриллярные белки характеризуются высокой механической прочностью, они выполняют в организме защитные и структурные функции. Типичные представители данных протеинов – кератины волос и коллагены тканей.
Глобулярные белки состоят из одной или нескольких полипептидных цепей, свёрнутых в компактную структуру эллипсоидной формы. К ним относят ферменты, транспортные компоненты крови, белки тканей.
Мембранные соединения – полипептидные структуры, которые встроены в оболочку клеточных органелл. Данные соединения выполняют функцию рецепторов, пропуская через поверхность необходимые молекулы и специфические сигналы.
На сегодняшний день насчитывается огромное разнообразие белков, определяемое числом входящих в них аминокислотных остатков, пространственной структурой и последовательностью их расположения.
Однако для нормальной жизнедеятельности организма требуется всего 20 альфа – аминокислот L – ряда, 8 из которых не синтезируются человеческим организмом.

Физические и химические свойства

Пространственная структура и аминокислотный состав каждого белка определяют его характерные физико-химические свойства.
Белки – твёрдые вещества, при взаимодействии с водой образуют коллоидные растворы. В водных эмульсиях протеины присутствуют в виде заряженных частиц, поскольку в состав входят полярные и ионные группировки (–NH2, –SH, –COOH, –OH). Заряд белковой молекулы зависит от соотношения карбоксильных (–СООН), аминных (NH) остатков и рН среды. Интересно, что в структуре протеинов животного происхождения больше дикарбоновых аминокислот (глютаминовой и аспарагиновой), что определяет их отрицательный потенциал в водных растворах.
Некоторые вещества содержат значительное количество диаминокислот (гистидина, лизина, аргинина), ввиду чего они ведут себя в жидкостях как белки-катионы. В водных растворах соединение устойчиво за счет взаимного отталкивания частиц с одноимёнными зарядами. Однако изменение рН среды влечёт за собой количественную модификацию ионизированных групп в протеине.
В кислой среде распад карбоксильных групп подавляется, что ведёт к снижению отрицательного потенциала белковой частицы. В щелочи, наоборот, замедляется ионизация аминных остатков, вследствие чего положительный заряд протеина уменьшается.
При определённом показателе рН, так называемом изоэлектрической точке, щелочная диссоциация эквивалентна кислотной, вследствие чего белковые частицы агрегируют и выпадают в осадок. У большинства пептидов данная величина находится в слабокислой среде. Однако встречаются структуры с резким преобладанием щелочных свойств. Это означает, что основная масса белков сворачивается в кислой среде, а малая часть – в щелочной.
В изоэлектирческой точке белки неустойчивы в растворах, и как следствие, легко свёртываются при нагревании. При добавлении кислоты или щёлочи к протеину, выпавшему в осадок, происходит перезарядка молекул, после чего соединение вновь растворяется. Однако белки сохраняют характерные свойства только при определённых параметрах рН среды. Если каким-то образом разрушить связи, которые удерживают пространственную структуру протеина, то упорядоченная конформация вещества деформируется, вследствие чего молекула принимает форму случайного хаотичного клубка. Данное явление называют денатурацией.
К изменению свойств белка ведет воздействие химических и физических факторов: высокой температуры, облучения ультрафиолетом, энергичным встряхиванием, соединением с протеиновыми осадителями. В результате денатурации компонент теряет биологическую активность, утраченные свойства не возвращаются.
Протеины дают цветное окрашивание в ходе реакций гидролиза. При соединении пептидного раствора с сульфатом меди и щёлочью появляется сиреневый окрас (биуретовая реакция), при нагревании белков в азотной кислоте – жёлтый оттенок (ксантопротеиновая реакция), при взаимодействии с азотнокислым раствором ртути – малиновый цвет (реакция Милона). Данные исследования используют для обнаружения протеиновых структур различного типа.
Виды белков по возможности синтеза в организме
Значение аминокислот для организма человека нельзя недооценивать. Они выполняют роль нейромедиаторов, нужны для правильной работы головного мозга, снабжают энергией мышцы, контролируют адекватность выполнения своих функций витаминами и минералами.
Главным образом значение соединения заключается в обеспечении нормального развития и функционирования организма. Аминокислоты вырабатывают ферменты, гормоны, гемоглобин, антитела. Синтез белков в живых организмах идет постоянно.
Однако данный процесс приостанавливается, если в клетках отсутствует хоты бы одна незаменимая аминокислота. Нарушение образования протеинов приводит к расстройствам пищеварения, замедлению роста, психо-эмоциональной неустойчивости.
Большая часть аминокислот синтезируется в организме человека в печени. Однако существуют такие соединения, которые должны в обязательном порядке ежедневно поступать с продуктами питания.
Этим обусловлено распределение аминокислот на следующие категории:
- незаменимые;
- полузаменимые;
- заменимые.
Каждая группа веществ обладает специфическими функциями. Рассмотрим их подробно.
Незаменимые аминокислоты

Органические соединения данной группы человек не в состоянии производить самостоятельно, однако они необходимы для поддержания его жизнедеятельности.
Поэтому такие аминокислоты приобрели название «незаменимые» и должны регулярно поступать извне с пищей. Синтез белка без данного строительного материала невозможен. Как следствие – нехватка хотя бы одного соединения приводит к нарушению обмена веществ, уменьшению мышечной массы, веса тела и остановке выработке протеина.
Самые значимые аминокислоты для человеческого организма, в частности для спортсменов и их значение.
- . Это структурный компонент белка с разветвленными цепями (ВСАА).Является источником энергии, участвует в обменных реакциях азота, восстанавливает поврежденные ткани, регулирует уровень гликемии. Валин необходим для протекания метаболизма в мускулах, нормальной умственной деятельности. Используется в медицинской практике в сочетании с лейцином, изолейцином для лечения головного мозга, печени, пострадавших в результате лекарственной, алкогольной или наркотической интоксикации организма.
- Лейцин и изолейцин. Снижают уровень глюкозы в крови, защищают мышечные ткани, сжигают жир, служат катализаторами для синтеза гормона роста, восстанавливают кожу, кости. Лейцин, как и валин, участвует в процессах энергообеспечения, что особенно важно для поддержания выносливости организма во время изнурительных тренировок. Помимо этого, изолейцин нужен для синтеза гемоглобина.
- Треонин. Препятствует жировому перерождению печени, участвует в белковом и жировом обменах, синтезе коллагена, эластана, создании костной ткани (эмали). Аминокислота повышает иммунитет, восприимчивость организма к ОРВИ заболеваниям. Треонин находится в скелетной мускулатуре, центральной нервной системе, сердце, поддерживая их работу.
- Метионин. Улучшает пищеварение, участвует в переработке жиров, защищает организм от вредного влияния радиации, уменьшает проявления токсикоза при беременности, используется для лечения ревматоидного артрита. Аминокислота участвует в выработке таурина, цистеина, глутатиона, которые обезвреживают и выводят из организма токсические вещества. Метионин помогает уменьшить уровень гистамина в клетках у людей, страдающих аллергией.
- Триптофан. Стимулирует выброс гормона роста, улучшает сон, уменьшает вредное воздействие никотина, стабилизирует настроение, используется для синтеза серотонина. Триптофан в человеческом организме способен превращаться в ниацин.
- Лизин. Участвует в продуцировании альбуминов, ферментов, гормонов, антител, восстановлении тканей и формировании коллагена. Данная аминокислота входит в состав всех протеинов и необходима для снижения уровня триглицеридов в сыворотке крови, нормального формирования костей, полноценного усвоения кальция и утолщения структуры волос. Лизин оказывает противовирусное действие, подавляя развитие острых респираторных инфекций и герпеса. Он увеличивает мышечную силу, поддерживает обмен азота, улучшает краткосрочную память, эрекцию, либидо. Благодаря положительным свойствам 2,6-диаминогексановая кислота помогает сохранить здоровым сердце, предотвращает развитие атеросклероза, остеопороза, генитального герпеса. Лизин в комбинации с витамином С, пролином препятствуют образованию липопротеинов, которые вызывают закупорку артерий и ведут к сердечно-сосудистым патологиям.
- Фенилаланин. Подавляет аппетит, уменьшает болевые ощущения, улучшает настроение, память. В человеческом организме фенилаланин способен трансформироваться в аминокислоту – тирозин, которая жизненно необходима для синтеза нейромедиаторов (допамина и норэпинефрина). Благодаря способности соединения проникать через гематоэнцефалический барьер, оно часто используется для устранения неврологических заболеваний. Помимо этого аминокислота применяется для борьбы с белыми очагами депигментации на коже (витилиго), шизофренией, болезнью Паркинсона.
Недостаток незаменимых аминокислот в организме человека приводит к:
- задержке роста;
- нарушению биосинтеза цистеина, белков, работы почек, щитовидной железы, нервной системы;
- слабоумию;
- уменьшению массы тела;
- фенилкетонурии;
- снижению иммунитета и уровня гемоглобина в крови;
- расстройству координации движений.
При занятиях спортом дефицит вышеописанных структурных единиц снижает спортивные результаты, увеличивая риск получения травм.
Пищевые источники незаменимых аминокислот
Таблица составлена на основании данных, взятых с сельскохозяйственной библиотеки США – USA National Nutrient Database.
Полузаменимые

Соединения, принадлежащие данной категории, способны вырабатываться организмом только при условии частичного их поступления с продуктами питания. Каждая разновидность полузаменимых кислот выполняет особые функции, которые нельзя заменить.
Рассмотрим их виды.
- . Это одна из самых важных аминокислот в организме человека. Она ускоряет заживление поврежденных тканей, снижает уровень холестерина и нужна для поддержания здоровья кожи, мышц, суставов, печени. Аргинин увеличивает образование Т-лимфоцитов, укрепляющих иммунную систему, служит барьером, препятствуя внедрению болезнетворных микроорганизмов. Помимо этого, аминокислота способствует дезинтоксикации печени, снижает кровяное давление, замедляет рост опухолей, противостоит образованию тромбов, повышает потенцию и усиливает кровенаполнение сосудов. Участвует в азотистом обмене, синтезе креатина и показана людям, желающим сбросить вес и набрать мышечную массу. Аргинин содержится в семенной жидкости, соединительной ткани кожного покрова и гемоглобине. Дефицит соединения в организме человека опасен развитием сахарного диабета, бесплодием у мужчин, задержкой полового созревания, гипертонией, иммунодефицитом. Естественные источники аргинина: шоколад, кокос, желатин, мясо, молочные продукты, грецкий орех, пшеница, овес, арахис, соя.
- Гистидин. Входит в состав всех тканей человеческого организма, ферментов. Участвует в обмене информацией между центральной нервной системой и периферическими отделами. Гистидин необходимый для нормального пищеварения, поскольку образование желудочного сока возможно только при его участии. Помимо этого, вещество предупреждает возникновение аутоиммунных, аллергических реакций. Недостаток компонента вызывает ослабление слуха, повышает риск развития ревматоидного артрита. Гистидин содержится в зерновых (рисе, пшенице), молочных продуктах, мясе.
- Тирозин. Содействует образованию нейромедиаторов, снижает болезненные ощущения предменструального периода, способствует нормальному функционированию всего организма, выступает природным антидепрессантом. Аминокислота снижает зависимость от наркотических, кофеиновых препаратов, помогает контролировать аппетит и служит исходным компонентом для продуцирования дофамина, тироксина, эпинефрина. При синтезе белка тирозин частично заменяет фенилаланин. Помимо этого, он нужен для синтеза гормонов щитовидной железы. Дефицит аминокислоты замедляет обменные процессы, снижает артериальное давление, повышает утомляемость.Тирозин содержится в семенах тыквы, миндале, овсянке, арахисе, рыбе, авокадо, соевых бобах.
- Цистин. Находится в бета-кератине – главном структурном белке волос, ногтевых пластин, кожи. Аминокислота всасывается в виде N-ацетил цистеина и используется при лечении кашля курильщика, септического шока, рака, бронхита. Цистин поддерживает третичную структуру пептидов, протеинов, а также выступает мощным антиоксидантом. Он связывает разрушительные свободные радикалы, токсичные металлы, защищает клетки от рентгеновских лучей и воздействия радиации. Аминокислота входит в состав соматостатина, инсулина, иммуноглобулина. Цистин можно получить со следующими продуктами питания: брокколи, лук, мясные изделия, яйца, чеснок, красный перец.
Отличительная особенность полузаменимых аминоксилот – возможность их использования организмом для образования протеинов вместо метионина, фенилаланина.
Заменимые

Органические соединения данного класса организм человека может производить самостоятельно, покрывая минимальные потребности внутренних органов и систем. Заменимые аминокислоты синтезируются из обменных продуктов и усваиваемого азота. Для восполнения суточной нормы, они должны ежедневно поступать в составе белков с пищей.
Рассмотрим какие вещества относятся к данной категории:
- . Используется в качестве источника энергии, выводит токсины из печени, ускоряет превращение глюкозы. Препятствует распаду мышечной ткани за счет цикла аланина, представленного в следующем виде: глюкоза – пируват – аланин – пируват – глюкоза. Благодаря данным реакциям, строительный компонент белка увеличивает запасы энергии, продлевая жизнь клеток. Избыток азота в ходе цикла аланина удаляется из организма с мочой. Помимо этого, вещество стимулирует выработку антител, обеспечивает метаболизм кислот, сахаров и повышает иммунитет. Источники аланина: молочные продукты, авокадо, мясо, птица, яйца, рыба.
- Глицин. Участвует в построении мышц, синтезе гормонов, повышает уровень креатина в организме, способствует превращению глюкозы в энергию. Коллаген на 30% состоит из глицина. Клеточный синтез невозможен без участия данного соединения. Фактически при повреждении тканей, без глицина человеческий организм не сможет заживлять раны. Источниками аминокислоты выступают: молоко, бобы, сыр, рыба, мясо.
- Глютамин. После превращения органического соединения в глютаминовую кислоту, она проникает через гематоэнцефалический барьер и выступает топливом для работы головного мозга. Аминокислота удаляет токсины из печени, увеличивает уровень ГАМК, поддерживает мышцы в тонусе, улучшает концентрацию внимания и участвует в продуцировании лимфоцитов. Препараты L-глютамина, как правило, применяются в бодибилдинге для предупреждения разрушения мышечной ткани путем транспорта азота в органы, выведения токсичного аммиака и повышения запасов гликогена. Вещество используется для снятия симптомов хронической усталости, улучшения эмоционального фона, лечения ревматоидного артрита, язвенной болезни, алкоголизма, импотенции, склеродермии. Лидерами по содержанию глютамина являются петрушка и шпинат.
- Карнитин. Связывает и выводит жирные кислоты из организма. Аминокислота усиливает действия витаминов Е, С, уменьшает избыточный вес, снижает нагрузку на сердце. В теле человека карнитин вырабатывается из глутамина и метионина в печени, почках. Он бывает следующих видов: D и L. Наибольшую ценность для организма представляет L-карнитин, который повышает для жирных кислот проницаемость клеточных мембран. Таким образом, аминокислота увеличивает утилизацию липидов, замедляет синтез молекул триглицеридов в подкожно-жировом депо. После приема карнитина усиливается окисление липидов, запускается процесс потери жировой ткани, что сопровождается высвобождением энергии, запасаемой в виде АТФ. L-карнитин усиливает создание лецитина в печени, снижает уровень холестерина, препятствует появлению атеросклеротических бляшек. Несмотря на то, что данная аминокислота не относится к категории незаменимых соединений, регулярный прием вещества предупреждает развитие патологий сердца и позволяет достичь активного долголетия. Помните, уровень карнитина с возрастом падает, поэтому пожилым людям стоит в первую очередь дополнительно вводить биологически активную добавку в ежедневный рацион. Кроме того, большая часть вещества синтезируется из витаминов С, B6, метионина, железа, лизина. Нехватка какого-либо из данных соединений вызывает дефицит L-карнитина в организме.Природные источники аминокислоты: птица, яичные желтки, тыква, кунжутные семечки, баранина, творог, сметана.
- Аспарагин. Нужен для синтеза аммиака, правильной работы нервной системы. Аминокислота содержится в молочных продуктах, спарже, сыворотке, яйцах, рыбе, орехах, картофеле, мясе птицы.
- Аспарагиновая кислота. Участвует в синтезе аргинина, лизина, изолейцина образовании универсального топлива для организма – аденозинтрифосфата (АТФ), обеспечивающего энергией внутриклеточные процессы. Аспарагиновая кислота стимулирует продукцию нейромедиаторов, повышает концентрацию никотинамидадениндинуклеотида (NADH), необходимого для поддержания работы нервной системы, головного мозга. Соединение синтезируется самостоятельно, при этом увеличить его концентрацию в клетках можно путем включения в рацион питания следующих продуктов: сахарного тростника, молока, говядины, мяса птицы.
- Глютаминовая кислота. Представляет собой самый важный возбуждающий нейромедиатор спинного, головного мозга. Органическое соединение участвует в перемещении калия через гематоэнцефалический барьер в спинномозговую жидкость и играет основную роль в метаболизме триглицеридов. Головной мозг способен использовать глутамат в качестве топлива. Потребность организма в дополнительном поступлении аминокислоты возрастает при эпилепсии, депрессивных состояниях, появлении ранней седины (до 30 лет), нарушениях работы нервной системы.Природные источники глютаминовой кислоты: грецкие орехи, помидоры, грибы, морепродукты, рыба, йогурт, сыр, сухофрукты.
- Пролин. Стимулирует синтез коллагена, нужен для формирования хрящевой ткани, ускоряет процессы заживления.Источники пролина: яйца, молоко, мясо.Вегетарианцам рекомендуется принимать аминокислоту с пищевыми добавками.
- Серин. Регулирует количество кортизола в мышечной ткани, участвует в синтезе антител, иммуноглобулинов, серотонина, способствует абсорбции креатина, играет роль в метаболизме жиров. Серин поддерживает нормальную работу центральной нервной системы. Главные пищевые источники аминокислоты: цветная капуста, брокколи, орехи, яйца, молоко, соевые бобы, кумыс, говядина, пшеница, арахис, мясо птицы.
Таким образом, аминокислоты задействованы в протекании всех жизненно важных функций в организме человека. Перед приобретением пищевых добавок рекомендуется проконсультироваться со специалистом. Несмотря на то, что прием препаратов аминокислот хоть и считается безопасным, однако может обострить скрытые проблемы со здоровьем.
Виды белка по происхождению

Сегодня различают следующие виды протеина: яичный, сывороточный, растительный, мясной, рыбный.
Рассмотрим описание каждого из них.
- Яичный. Считается эталоном среди белков, все остальные протеины оцениваются относительно него, поскольку он имеет наивысшую усвояемость. В состав желтка входят овомукоид, овомуцин, лизоцин, альбумин, овоглобулин, коальбумин, авидин, а белковой составляющей является альбумин. Куриные яйца в сыром виде не рекомендуется принимать людям с нарушениями пищеварительного тракта. Это связано с тем, что в них содержится ингибитор фермента трипсина, замедляющий переваривание пищи, и белок авидин, присоединяющий жизненно важный витамин Н. Образуемое в итоге соединение не усваивается организмом и выводится наружу. Поэтому диетологи настаивают на употреблении яичного белка исключительно после термической обработки, которая высвобождает нутриент из биотин-авидинового комплекса и разрушает ингибитор трипсина. Достоинства данной разновидности протеина: имеет среднюю скорость абсорбции (9 грамм в час), высокие показатели аминокислотного состава, способствует снижению массы тела. К недостаткам белка куриных яиц относятся их высокая стоимость и аллергенность.
- Молочной сыворотки. Белки данной категории обладают наивысшей скоростью расщепления (10-12 грамм в час) среди цельных протеинов. После приема продуктов на основе молочной сыворотки, в течение первого часа уровень петидов и аминокислот в крови резко увеличивается. При этом, кислотообразующая функция желудка не меняется, что исключает вероятность образования газов и нарушения процесса пищеварения. Состав мышечной ткани человека по содержанию незаменимых аминокислот (валина, лейцина и изолейцина) наиболее близок к составу сывороточных белков. Данная разновидность протеина снижает уровень холестерина, повышает количество глутатиона, имеет низкую стоимость относительно других видов аминокислот. Главный недостаток сывороточного белка – быстрая всасываемость соединения, что делает целесообразным его прием до или сразу после тренировки. Основным источником протеина выступает сладкая молочная сыворотка, получаемая в процессе производства сычужных сыров. Различают концентрат, изолят, гидролизат сывороточного протеина, казеин. Первая из полученных форм не отличается высокой чистотой и содержит жиры, лактозу, которая стимулирует газообразование. Уровень протеина в ней составляет 35-70%. По данной причине концентрат сывороточного белка – самая дешевая форма строительного материала в кругах спортивного питания. Изолят – продукт с более высоким уровнем очистки, он содержит 95% протеиновых фракций. Однако недобросовестные производители иногда хитрят, предоставляя в качестве сывороточного белка смесь изолята, концентрата, гидролизата. Поэтому следует тщательно проверять состав добавки, в которой единственным компонентом должен выступать изолят. Гидролизат – самый дорогой вид сывороточного протеина, который готов к немедленному усвоению и быстро проникает в мышечную ткань. Казеин при попадании в желудок превращается в сгусток, который долго расщепляется (4-6 грамм в час). Благодаря данному свойству белок входит в состав смесей для детского питания, поскольку поступает в организм стабильно и равномерно, в то время как интенсивный поток аминокислот ведет к отклонениям в развитии малыша.
- Растительный. Несмотря на то, что протеины в таких продуктах неполноценны, в сочетании друг с другом они формируют полноценный белок (наилучшая комбинация – бобовые + зерновые). Основными поставщиками строительного материала растительного происхождения являются соевые продукты, которые борются с остеопорозом, насыщают организм витаминами Е, В, фосфором, железом, калием, цинком. При употреблении соевый белок снижает уровень холестерина, решает проблемы, связанные с увеличением простаты, уменьшает риск развития злокачественных новообразований в груди. Он показан людям, страдающим непереносимостью молочных продуктов. Для производства добавок применяются соевый изолят (содержит 90% протеина), соевый концентрат (70%), соевую муку (50%). Скорость всасывания белка – 4 грамма в час. К недостаткам аминокислоты относятся: эстрогенная активность (за счет этого соединение не следует принимать мужчинам в больших дозах, поскольку может возникнуть нарушение репродуктивной функции), наличие трипсина, замедляющего пищеварение. Растения, содержащие фитоэстрогены (нестероидные соединения сходные по структуре с женскими половыми гормонами): лен, солодка, хмель, красный клевер, люцерна, красный виноград. Растительный белок также находится в овощах и фруктах (капусте, гранатах, яблоках, моркови), злаковых и бобовых (рисе, люцерне, чечевице, семенах льна, овсе, пшенице, сое, ячмене), напитках (пиве, бурбоне).Часто в спортивном питании используется гороховый протеин. Это высокоочищенный изолят, содержащий наибольшее количество аминокислоты аргинина (8,7% на грамм белка) относительно сывороточного компонента, сои, казеина и яичного материала. Помимо этого, гороховый протеин богат на глутамин, лизин. Количество ВСАА в нем достигает 18%. Интересно, что рисовый протеин усиливает преимущества гипоаллергенного горохового белка, используется в питании сыроедов, атлетов, вегетарианцев.
- Мясной. Количество протеина в нем достигает 85%, из которых 35% составляют незаменимые аминокислоты. Мясной белок характеризуется нулевым содержанием жира, имеет высокий уровень всасывания.
- Рыбный. Данный комплекс рекомендуется к употреблению обычному человеку. Но использовать белок для покрытия суточной потребности спортсменам крайне нежелательно, поскольку изолят рыбного протеина в 3 раза дольше расщепляется до аминокислот, чем казеин.
Таким образом, для снижения веса, набора мышечной массы, при работе на рельеф рекомендуется применять комплексные протеины. Они обеспечивают пиковую концентрацию аминокислот сразу после употребления.
Тучным спортсменам, склонным к образованию жира, стоит отдать предпочтение 50-80% медленному белку относительно быстрого. Их основной спектр действия направлен на продолжительное питание мускулатуры.
Всасывание казеина происходит медленнее сывороточного протеина. Благодаря этому концентрация аминокислот в крови повышается постепенно и удерживается в течение 7 часов на высоком уровне. В отличие от казеина, сывороточный белок намного быстрее всасывается в организме, что создает сильнейший выброс соединения на протяжении короткого периода времени (получаса). Поэтому его рекомендуется принимать для предотвращения катаболизма мышечных протеинов непосредственно до и сразу после тренировки.
Промежуточную позицию занимает яичный белок. Для насыщения крови сразу после физической нагрузки и поддержания высокой концентрации протеина после силовых упражнений его прием следует сочетать с сывороточным изолятом, аминокислотой скора. Данная смесь из трех белков нивелирует недостатки каждого компонента, совмещает все положительные качества. Наиболее совместим с сывороточным соевым протеином.
Значение для человека

Роль, которую протеины играют в живых организмах настолько велика, что рассмотреть каждую функцию практически невозможно, однако мы кратко осветим важнейшие из них.
- Защитная (физическая, химическая, иммунная). Белки ограждают организм от пагубного влияния вирусов, токсинов, бактерий, запуская механизм синтеза антител. При взаимодействии защитных белков с чужеродными веществами происходит нейтрализация биологического действия патогенов. Помимо этого, протеины участвуют в процессе свертывания фибриногена в плазме крови, что способствует образованию сгустка и закупорке раны. Благодаря этому в случае повреждения телесных покров белок защищает организм от кровопотерь.
- Каталитическая. Все ферменты, так называемые биологические катализаторы, являются протеинами.
- Транспортная. Главным переносчиком кислорода является гемоглобин, белок крови. Помимо этого, другие виды аминокислот в процессе реакций образуют соединения с витаминами, гормонами, жирами, обеспечивая их доставку к клеткам, внутренним органам, тканям.
- Питательная. Так называемые резервные протеины (казеин, альбумин) – это источники питания для формирования и роста плода в утробе матери.
- Гормональная. Большинство гормонов в организме человека (адреналин, норадреналин, тироксин, глюкагон, инсулин, кортикотропин, соматотропин) являются белками.
- Строительная. Кератин – основной структурный компонент волос, коллаген – соединительной ткани, эластин – стенок сосудов. Белки цитоскелета придают форму органоидам, клеткам. Большинство структурных протеинов – филаментозные.
- Двигательная. Актин и миозин (белки мускул) участвуют в расслаблении и сокращении мышечных тканей. Протеины регулируют трансляцию, сплайсинг, интенсивность транскрипции генов, а также процесс передвижения клетки по циклу. Моторные белки отвечают за движение организма, перемещение клеток на молекулярном уровне (ресничек, жгутиков, лейкоцитов), внутриклеточный транспорт (кинезин, динеин).
- Сигнальная. Данную функцию выполняют цитокины, факторы роста, белки-гормоны. Они передают сигналы между органами, организмами, клетками, тканям.
- Рецепторная. Одна часть белкового рецептора принимает раздражающий сигнал, другая – реагирует и способствует конформационным изменениям. Так, соединения катализируют химическую реакцию, связывают внутриклеточные молекулы-посредники, служат ионными каналами.
Помимо вышеперечисленных функций, белки регулируют уровень pH внутренней среды, выступают резервным источником энергии, обеспечивают развитие, размножение организма, формируют способность к мышлению.
В комплексе с триглицеридами протеины участвуют в закладке клеточных мембран, с углеводами – в продуцировании секретов.
Синтез белков

Синтез белков – сложный процесс, протекающий в рибонуклеопротеиновых частицах клетки (рибосомах). Протеины трансформируются из аминокислот и макромолекул под контролем информации, зашифрованной в генах (в ядре клетки).
Каждый белок состоит из ферментных остатков, которые определяются нуклеотидной последовательностью генома, кодирующего данную часть клетки. Поскольку ДНК сосредоточено в ядре клетки, а синтез протеинов идёт в цитоплазме, информацию с кода биологической памяти на рибосомы передаёт специальный посредник, называемый и-РНК.
Биосинтез белка происходит в шесть этапов.
- Передача информации с ДНК на и-РНК (транскрипция). В клетках прокариот переписывание генома начинается с опознания ферментом РНК-полимераза специфической последовательности нуклеотидов ДНК.
- Активация аминокислот. Каждый «предшественник» белка, используя энергию АТФ, связывается ковалентными связями с молекулой транспортной РНК (т-РНК). При этом т-РНК состоит из последовательно соединённых нуклеотидов – антикодонов, которые определяют индивидуальный генетический код (триплет-кодон) активируемой аминокислоты.
- Связывание белков с рибосомами (инициация). Молекула и-РНК, содержащая информацию о конкретном протеине, соединяется с малой частицей рибосомы и инициирующей аминокислотой, прикрепленной к соответствующей т-РНК. При этом транспортные макромолекулы взаимно соответствуют и-РНК триплету, который сигнализирует о начале протеиновой цепи.
- Удлинение полипептидной цепи (элонгация). Наращивание белковых фрагментов происходит путём последовательного прибавления аминокислот к цепи, транспортируемых к рибосоме при помощи транспортных РНК. На данном этапе формируется окончательная структура протеина.
- Остановка синтеза полипептидной цепи (терминация). О завершении построения белка сигнализирует специальный триплет и-РНК, после чего полипептид высвобождается из рибосомы.
- Сворачивание и процессинг белка. Для принятия характерной структуры полипептид, самопроизвольно свёртывается, образуя свойственную ему пространственную конфигурацию. После синтеза на рибосоме, белок подвергается химической модификации (процессингу) со стороны ферментов, в частности, фосфорилированию, гидроксилированию, гликозилированию, тирозинированию.
Новообразованные протеины содержат на конце полипептидные фрагменты, которые выполняют функцию сигналов, направляющих вещества к области воздействия.
Трансформацией белков управляют гены-операторы, которые в совокупности со структурными генами образуют ферментативную группу, называемую оперон. Эту систему контролируют гены-регуляторы при помощи специальной субстанции, которую они, при потребности, синтезируют. Взаимодействие этого вещества с оператором приводит к блокировке контролирующего гена, и как следствие, прекращению работы оперона. Сигналом к возобновлению работы системы служит реагирование субстанции с частицами-индукторами.
Суточная норма
Как видно, потребность организма в белках зависит от возраста, пола, физического состояния, нагрузки. Недостаточность протеина в продуктах приводит к нарушению деятельности внутренних органов.
Обмен в человеческом организме

Белковый метаболизм – совокупность процессов, отражающих деятельность протеинов внутри организма: переваривание, расщепление, усвоение в пищеварительном тракте, а также участие в синтезе новых веществ, требуемых для жизнеобеспечения. Учитывая, что протеиновый обмен регулирует, интегрирует и координирует большинство химических реакций, важно понимать основные этапы трансформаций белка.
В метаболизме пептидов ключевую роль играет печень. Если фильтрующий орган прекращает участие в данном процессе, то через 7 дней наступает летальный исход.
Последовательность протекания обменных процессов.
- Дезаминирование аминокислот. Данный процесс необходим для преобразования излишка белковых структур в жиры и углеводы. В ходе ферментативных реакций, аминокислоты модифицируются в соответствующие кетокислоты, образуя побочный продукт распада – аммиак. Дезанимирование 90% белковых структур происходит в печени, а в некоторых случаях в почках. Исключение составляют аминокислоты с разветвлённым радикалом (валин, лейцин, изолейцин), подвергающиеся метаболизму в мышцах скелета.
- Образование мочевины. Аммиак, который выделился при дезаминировании аминокислот, токсичен для человеческого организма. Обезвреживание ядовитого вещества происходит в печени под воздействием ферментов, превращающих его в мочевую кислоту. После этого мочевина поступает в почки, откуда выводится вместе с мочой. Остаток молекулы, не содержащий азота, модифицируется в глюкозу, которая при распаде освобождает энергию.
- Взаимопревращения между заменимыми видами аминокислот. В результате биохимических реакций в печени (восстановительного аминирования, трансаминирования кетокислот, аминокислотных преобразований) происходит образование заменимых и условно-незаменимых белковых структур, которые компенсируют их нехватку в пищевом рационе.
- Синтез белков плазмы. Практически все белки крови, за исключением глобулинов, образуются в печени. Наиболее важные из них и преобладающие в количественном отношении – альбумины и факторы свёртывания крови.
Процесс переваривания белков в пищеварительном тракте происходит путём последовательного воздействия на них протеолитических ферментов для придания продуктам распада способности всасываться в кровь через кишечную стенку.
Расщепление протеинов начинается в желудке под влиянием желудочного сока (рН 1,5-2), который содержит фермент пепсин, ускоряющий гидролиз пептидных связей между аминокислотами. После этого переваривание продолжается в двенадцатиперстной и тощей кишке, куда поступают панкреатический и кишечный сок (рН 7,2-8,2), содержащий неактивные предшественники энзимов (трипсиноген, прокарбоксипептидазу, химотрипсиноген, проэластазу). Слизистой оболочкой кишечника вырабатывается фермент энтеропептидаза, который активирует данные протеазы. Протеолитические вещества содержатся и в клетках слизистой выстилки кишечника, ввиду чего гидролиз малых пептидов происходит после окончательного всасывания.
В результате таких реакций, 95-97 % белков расщепляются до свободных аминокислот, которые абсорбируются в тонком кишечнике. При нехватке или низкой активности протеаз, неусвоенный белок поступает в толстый кишечник, где подвергается процессам гниения.
Белковая недостаточность

Белки – класс высокомолекулярных азотсодержащих соединений, функциональная и структурная составляющая жизнедеятельности человека. Учитывая, что протеины отвечают за построение клеток, тканей, органов, синтез гемоглобина, ферментов, пептидных гормонов, нормальное протекание обменных реакций, их недостаток в пищевом рационе приводит к нарушению функционирования всех систем организма.
Симптомы белковой недостаточности:
- гипотония и дистрофия мышц;
- снижение трудоспособности;
- уменьшение толщины кожной складки, особенно над трёхглавой мышцей плеча;
- резкое похудение;
- психическая и физическая утомляемость;
- отёки (скрытые, а затем явные);
- зябкость;
- уменьшение тургора кожи, вследствие чего она становится сухой, дряблой, вялой, морщинистой;
- ухудшение функционального состояния волос (выпадение, истончение, сухость);
- снижение аппетита;
- плохое заживление ран;
- постоянное ощущение голода или жажды;
- нарушение когнитивных функций (памяти, внимания);
- отсутствие прибавки в весе (у детей).
Помните, признаки легкой формы белковой недостаточности продолжительное время могут отсутствовать или быть скрытыми.
Однако любая фаза протеинового дефицита сопровождается ослаблением клеточного иммунитета и повышением восприимчивости к инфекциям.
Вследствие этого пациенты чаще болеют респираторными заболеваниями, пневмониями, гастроэнтеритами, патологиями мочеполовых органов. При продолжительной нехватке азотистых соединений развивается тяжёлая форма белково-энергетической недостаточности, сопровождающаяся снижением объёма миокарда, атрофией подкожной клетчатки, западением межреберий.
Последствия тяжёлой формы дефицита белка:
- замедление пульса;
- ухудшение усвоения белка и других веществ вследствие неадекватного синтеза ферментов;
- уменьшение объёма сердца;
- анемия;
- нарушение имплантации яйцеклетки;
- задержка роста (у новорожденных);
- функциональные расстройства желёз внутренней секреции;
- гормональный сбой;
- иммунодефицитные состояния;
- обострение воспалительных процессов из-за нарушения синтеза защитных факторов (интерферона и лизоцима);
- снижение интенсивности дыхания.
Нехватка протеина в пищевом рационе особенно неблагоприятно влияет на детский организм: замедляется рост, нарушается образование костной ткани, задерживается умственное развитие.
Различают две формы белковой нехватки у детей:
- Маразм (сухая протеиновая недостаточность). Данное заболевание характеризуется выраженной атрофией мышц и подкожной клетчатки (ввиду утилизации белка), задержкой роста, снижением массы тела. При этом отёчность, явная или скрытая, в 95% случаев отсутствует.
- Квашиоркор (изолированная белковая недостаточность). На начальной стадии у ребёнка наблюдается апатия, раздражительность, вялость. Затем отмечаются задержка роста, гипотония мышц, жировая дистрофия печени, уменьшение тургора тканей. Наряду с этим появляются отёки, маскирующие снижение массы тела, гиперпигментация кожного покрова, шелушение отдельных участков тела, истончение волос. Часто при квашиоркоре возникают рвота, диарея, анорексия, а в тяжёлых случаях – кома или сопор, которые нередко заканчиваются летальным исходом.
Наряду с этим, у детей и взрослых, могут развиваться смешанные формы протеинового дефицита.
Причины развития белковой нехватки
Возможными причинами развития белковой нехватки являются:
- качественный или количественный дисбаланс питания (диеты, голодание, обеднённое протеинами меню, скудный пищевой рацион);
- врождённые нарушения метаболизма аминокислот;
- повышенные потери протеина с мочой;
- продолжительная нехватка микроэлементов;
- нарушение синтеза белка, вследствие хронических патологий печени;
- алкоголизм, наркомания;
- тяжёлые формы ожогов, кровотечений, инфекционных заболеваний;
- нарушения усвоения протеина в кишечнике.
Белково-энергетическая недостаточность бывает двух типов: первичная и вторичная. Первое расстройство обусловлено неадекватным поступлением полезных веществ в организм, а второе – следствием функциональных расстройств или приёма лекарственных препаратов, ингибирующих синтез ферментов.
При лёгкой и умеренной стадии белковой нехватки (первичной) важно устранить возможные причины развития патологии. Для этого увеличивают суточное потребление протеинов (соразмерно оптимальной массе тела), назначают приём поливитаминных комплексов. При отсутствии зубов или снижении аппетита дополнительно используют жидкие питательные смеси для зондового или самостоятельного питания. Если нехватка белка осложнена поносом, то больным предпочтительно давать йогуртовые составы. Ни в коем случае не рекомендуется употреблять молочные продукты ввиду неспособности организма перерабатывать лактозу.
Тяжёлые формы вторичной недостаточности требуют лечения в стационарных условиях, поскольку для идентификации расстройства необходимо проведение лабораторного исследования. Для уточнения причины патологии измеряют уровень растворимого рецептора интерлейкина-2 в крови или С-реактивного белка. Также берутся анализы на содержание альбумина плазмы, кожные антигены, общее число лимфоцитов и CD4+ Т-лимфоцитов, которые помогут подтвердить анамнез и определить степень функциональной дисфункции.
Главные приоритеты лечения – соблюдение контролируемой диеты, коррекция водно-электролитного баланса, устранение инфекционных патологий, насыщение организма нутриентами. Учитывая, что вторичная нехватка белка может препятствовать излечению от заболевания, которое спровоцировало ее развитие, в ряде случаев назначают парентеральное или зондовое питание концентрированными смесями. При этом витаминотерапию применяют в дозировках вдвое превышающих суточную потребность здорового человека.
Если у пациента наблюдается анорексия или причина дисфункции не выявлена, дополнительно используют препараты, повышающие аппетит. Для увеличения мышечной массы тела допустимо применение анаболических стероидов (под контролем врача). Восстановление баланса белка у взрослых наступает медленно, на протяжении 6-9 месяцев. У детей период полного выздоровления занимает 3-4 месяца.
Помните, для профилактики белковой недостаточности важно ежедневно включать в пищевой рацион протеиновые продукты растительного, животного происхождения.
Передозировка

Поступление пищи, богатой протеином в избыточном количестве оказывает негативное влияние на здоровье человека. Передозировка белка в рационе питания не менее опасна, чем недостаток.
Характерные симптомы излишка протеинов в организме:
- обострение проблем с почками, печенью;
- ухудшение аппетита, дыхания;
- повышенная нервная возбудимость;
- обильные менструальные выделения (у женщин);
- сложность избавления от избыточного веса;
- проблемы с сердечно-сосудистой системой;
- усиление процессов гниения в кишечнике.
Определить нарушение протеинового обмена можно при помощи азотистого равновесия. Если количество получаемого и выводимого азота равны, считается что человек имеет положительный баланс. Отрицательное равновесие свидетельствует о недостаточном поступлении или плохом усвоении белка, что приводит к сжиганию собственного протеина. Данное явление лежит в основе развития истощения.
Незначительное превышение белка в рационе, требуемое для поддержания нормального азотистого баланса, не представляет вреда для здоровья человека. В данном случае избыток аминокислот используется в качестве источника энергии. Однако при отсутствии физических нагрузок для большинства людей потребление белка в количестве, превышающем 1,7 грамм на 1 килограмм веса, способствует превращению излишка протеина в азотистые соединения (мочевину), глюкозу, которые должны выводить почки. Избыточное количество строительного компонента приводит к формированию кислой реакции организма, увеличению потери кальция. Помимо этого, в состав животного белка часто входят пурины, которые могут откладываться в суставах, что является предвестием развития подагры.
Передозировка белка в организме человека – крайне редкое явление. Сегодня в обычном рационе полноценных протеинов (аминокислот) катастрофически не хватает.
Часто задаваемые вопросы
Какие плюсы и минусы протеинов животного и растительного происхождения?

Главное достоинство животных источников белка заключается в том, что они содержат все необходимые для организма незаменимые аминокислоты, преимущественно в концентрированном виде. Минусы такого протеина – поступление избыточного количества строительного компонента, что в 2-3 раза превышает суточную норму. Помимо этого, изделия животного происхождения часто содержат вредные компоненты (гормоны, антибиотики, жиры, холестерин), которые вызывают отравление организма продуктами распада, вымывают «кальций» из костей, создают лишнюю нагрузку на печень.
Растительные белки хорошо усваиваются организмом. Они не содержат вредные компоненты, которые идут вместе с животными протеинами. Однако растительные белки не избавлены от недостатков. Большинство продуктов (кроме сои) сочетаются с жирами (в семенах), содержат неполный набор незаменимых аминокислот.
Какой белок лучше всего усваивается в человеческом организме?
- Яичный, степень всасывания достигает 95 – 100%.
- Молочный, сырный – 85 – 95%.
- Мясной, рыбный – 80 – 92%.
- Соевый – 60 – 80%.
- Зерновой – 50 – 80%.
- Бобовый – 40 – 60%.
Данная разбежность объясняется тем, что органы ЖКТ не вырабатывают ферменты, необходимые для расщепления всех видов белка.
Какие существуют рекомендации к употреблению протеинов?
- Покрывать суточную потребность организма.
- Следить за тем, чтобы с продуктами питания поступали разные комбинации белка.
- Не злоупотреблять приемом избыточного количества протеина в течение длительного периода.
- Не есть богатую белками пищу на ночь.
- Сочетать протеины растительного и животного происхождения. Это улучшит их усвоение.
- Для спортсменов перед тренировкой для преодоления высоких нагрузок рекомендуется выпить насыщенный белком протеиновый коктейль. После занятий восполнить запасы питательных веществ поможет гейнер. Спортивная добавка поднимает уровень углеводов, аминокислот в организме, стимулируя быстрое восстановление мышечной ткани.
- Животные белки должны составлять 50% дневного рациона.
- Для выведения продуктов белкового обмена требуется гораздо больше воды, чем для расщепления и переработки других компонентов пищи. Во избежание обезвоживания организма в день нужно пить 1,5-2 литра негазированной жидкости. Для поддержания водно-солевого баланса спортсменам рекомендуется употреблять 3 литра воды.
Сколько протеина может усвоиться за раз?
Среди сторонников частого питания бытует мнение, что за один прием пищи может усвоиться не больше 30 грамм белка. Считается, что больший объем нагружает пищеварительный тракт и он не способен справиться с перевариванием продукта. Однако это не более, чем миф.
Человеческий организм за один присест способен одолеть более 200 грамм протеина. Часть белка пойдет на участие в анаболических процессах или СМП и будет запасена в качестве гликогена. Главное помнить, чем больше протеина поступит в организм, тем дольше он будет его переваривать, но усвоится весь.
Чрезмерное количество белков приводит к увеличению отложения жира в печени, повышенной возбудимости желез внутренней секреции и центральной нервной системы, усиливает процессы гниения, негативно сказывается на работе почек.
Вывод
Белки – это составная часть всех клеток, тканей, органов в организме человека. Протеины отвечают за регуляторные, двигательные, транспортные, энергетические и обменные функции. Соединения участвуют в процессах всасывания минеральных веществ, витаминов, жиров, углеводов, повышают иммунитет и служат строительным материалом для мышечных волокон.
Ежедневное поступление белка в достаточном количестве (см. Таблица № 2 «Потребность человека в протеинах») – залог сохранения здоровья и хорошего самочувствия в течение дня.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Специальность: терапевт, невролог .
Общий стаж: 5 лет .
Место работы: БУЗ ОО «Корсаковская ЦРБ» .
Образование: Орловский государственный университет имени И.С. Тургенева .
В чем заключается строительная функция белков?
Белки – основа существования живой клетки. Они составляют большую часть ее элементов. Строительная функция белков заключается в их наличии во многих органах и тканях человека. Большинство плотных веществ состоит из белков. Например, мышцы, опорные ткани, ногти, волосы.
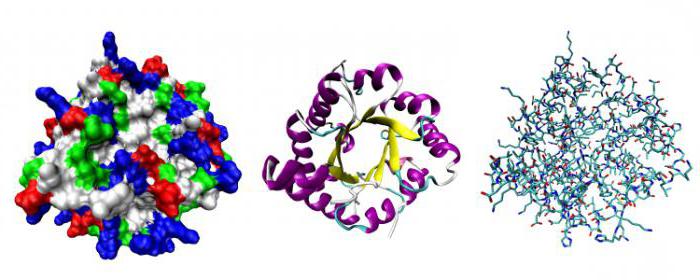
Белки – высокомолекулярные соединения. Например, молекула белка в несколько сот раз превышает по размерам молекулу воды. Любое белковое вещество образовывается за счет соединений, которые называются аминокислотами. Располагаются они в строгом порядке, следуя одна за другой, образуя длинную цепь, которая называется пептидной. Химические и биологические свойства белка определяются расположившимися в нем аминокислотами. Все выполняемые ими функции очень важны для живых организмов, и одна из них, строительная функция белков, находится в основе существования и развития всего живого.
Свойства белков
Исследования ученых доказали, что физические и химические свойства белка определяются присутствующими в нем аминокислотами, их количеством и последовательностью соединений.
- нерастворимые и растворимые в воде;
- неустойчивые, меняющиеся под незначительным воздействием на них, и устойчивые.
- длинных нитей;
- соединения маленьких шарообразных молекул.
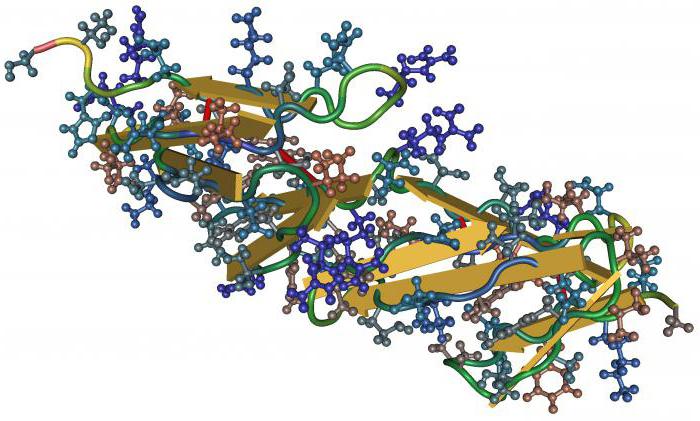
Однако при таком различном строении свойства белков строго отвечают выполняемым ими функциям. Например, белки в форме нитей присутствуют в мышцах, поскольку наделены способностью к сокращению. Белки легкорастворимые, со строением молекулы из маленьких шариков, выполняют функции транспортировки. Как катализатор используются белки с легко изменяемой структурой.
Функции белков
Каждое органическое вещество, находясь в теле, выполняет определенные функции. Рассмотрим, какие функции, обеспечивающие жизнедеятельность человека, выполняет белок:
- Строительную. Белок используется при образовании оболочек и мембран клеток, в составе кровеносных сосудов, сухожилий. Строительная функция белков, (примеры описаны в статье) полностью проявляется в таких органах и тканях, как кожа, волосы, ногти и пр.
- Двигательную.
- Каталитическую. В организме человека постоянно происходят разные химические реакции. Регулируют скорость их прохождения ферменты, которые состоят из белков.
- Транспортную. Белки осуществляют перенос по организму и всем тканям жизненно необходимых веществ. Например, белок гемоглобин переносит кислород.
- Защитную. Иммунная система вырабатывает белки-антитела как реакцию на вредные чужеродные микроорганизмы, попавшие внутрь организма. Белки-антитела блокируют атаку вредных веществ. Также существуют белки крови – фибриногены, которые способны предостеречь организм от потери крови путем образования сгустка (сворачивание крови).
- Гормональную. Гормоны отвечают за соблюдение равновесия в организме, регулируют обмен веществ, при этом большинство их состоит из белков или полипептидов.
- Питательную. Например, белок казеин присутствует в грудном молоке и отвечает за насыщение малыша.
Строительная функция белка – одна из главных, отвечающих за нормальную жизнедеятельность организма.
Количество белков в организме человека
Наличие белков в каждой живой клетке составляет не меньше половины ее сухого веса. Вообще в составе всех белков присутствует только двадцать аминокислот, при этом различные белковые соединения отличаются между собой количеством повторов и последовательностью соединений. В зависимости от этого белки и выполняют разные функции, одна из которых, необходимая для продолжения жизни, – строительная функция белков.
Белки распределены по организму неодинаково.
| Органы,ткани | % белка к массе сухой ткани |
| Кожа | 63 |
| Кости | 20 |
| Зубы | 18 |
| Мышцы | 80 |
| Мозг | 45 |
| Легкие | 82 |
| Селезенка | 84 |
| Печень | 57 |
| Жировые ткани | 14 |
Строительная функция белков
Где осуществляется она? В организме человека создание новых клеток и восстановление разрушенных тканей невозможно без наличия белка. Он также участвует в синтезе соков пищеварения, входит в состав иммунных тел, гормонов. Белок выполняет и энергетическую функцию: при больших физических нагрузках необходимо получать его для поддержания баланса питательных веществ организма.
Одна из основных функций белка – строительная. Если белок перестанет ее выполнять, живой организм не сможет существовать. Как проявляется строительная функция белков? Примеры белков и их действие на организм живых существ оисаны ниже:
- Кератин – белок, из которого состоят волосы, ногти; у животных – шерсть, рога, копыта. В зависимости от набора аминокислот, он может быть мягким и гибким, а может – жестким и прочным.
- Коллаген — присутствует в сухожилиях и хрящах, его волокна не растягиваются, поэтому мышечное усилие направляется на кости, к которым прикреплены мышцы.
- Эластин – белок, прочность которого не очень велика, при этом он имеет хорошую эластичность, под давлением способен легко растянуться. Находится в стенках сосудов.
Белок в клеточных скелетах
Строительная функция белка проявляется как в строении организма, так и в клетках – белки создают внутренний цитоскелет.
Существует три вида клеточного скелета:
- микротрубочки;
- микрофиламенты;
- филаменты.
Микротрубочки – это трубочки, состоящие из белка тубулина. С их помощью компоненты клетки переносятся по ней.
Микрофиламенты состоят из белка актина. Они создают мелкую непрерывную сетку под наружной мембраной клетки, таким образом, делая ее упругой и прочной.
Наличие определенного вида белка в промежуточных филаментах определяется тем, в каких клетках они находятся. Исходя из исследований, считается, что филаменты придают клетке прочность.
Аминокислоты
Аминокислоты – это связь углерода, водорода, кислорода и азота и (иногда) серы. Аминокислот существует более 100 видов, однако у человека присутствует всего лишь 20. Одни из них организм вырабатывает сам, а другие необходимо получать из продуктов питания.
Аминокислоты делятся на три вида:
- Заменимые – организм их синтезирует сам.
- Незаменимые – получаются из продуктов питания.
- Условно-заменимые – аминокислоты, которые могут синтезироваться организмом, однако для этого необходимо присутствие определенного количества других аминокислот.
Важность аминокислот
Наличие в организме основного набора аминокислот обязательно, поскольку их недостаток отразится на нарушениях функциональности тех органов, за которые они отвечают. Например, дефицит лизина в крови провоцирует понижение уровня гемоглобина, что губительно отражается на состоянии здоровья человека.
Одна аминокислота называется пептидом, связь 3-100 аминокислот – это маленький белок. Белки могут состоять из 100-800 последовательно соединенных аминокислот.
Итак, строительная функция белков где осуществляется? Она может проявляться на клеточном уровне и в строении организма человека. Белковые рецепторы содержатся и в цитоплазме, и в мембране клеток. Существующие моторные белки функционируют для обеспечения двигательной функции организма, например участвуют в сокращении мышц, перемещении клеток.
Строительная функция белков заключается в том, что белки присутствуют в клеточных мембранах, формируют скелет клетки, входят в состав рибосом, хромосом и других жизненно важных формирований.
Путь белка при строительной функции
Белок, выполняющий строительную функцию, проходит свой путь. Например, путь, который проходит белок, попавший в организм из пищи, следующий. Из продуктов питания он попадает в желудок, где расщепляется на аминокислоты. После чего они всасываются слизистой кишечника и попадают в печень, из которой распространяются по всем органам и тканям организма, чтобы обеспечить синтез белка. Строительная функция белков проявляется в том, что они участвуют во всех жизненно важных процессах организма.
Заключение
Для продолжения жизни человеку необходимо, чтобы в его клетках постоянно проходили различные химические реакции. И одну из главных ролей выполняют белки, благодаря которым осуществляется развитие и функционирование организма.
Строительная функция белков проявляется в формировании новых клеток и регенерации старых. Для регенерации необходимо присутствие нужного количества белка, чтобы его хватило на замену изношенных клеток.
Большой износ тканей и клеток наблюдается у людей, ведущих спортивный образ жизни. Поэтому им необходимо потреблять пищу, богатую белками. Также это касается и тех, кто занимается умственной деятельностью.
Белки способны связывать воду, образовывая коллоидные структуры. Можно сказать, что жизнь – это процесс существования белков, их взаимосвязи с окружающей средой. Если этот процесс прекратится, жизнь живого организма закончится.
Белки – основа пищи

Слово «белок» в переводе с греческого означает «первое, важное». И это неспроста. Белки – основной материал, из которого великий архитектор – природа – строит жизнь. Сама жизнь – это форма существования белковых тел. Ибо каждая клетка живого организма содержит белки, которые служат основным пластическим материалом, из которого строятся ткани человеческого организма. Он делает возможным основные проявления жизни: пищеварение, обмен веществ, сократимость мышц, раздражимость тканей, способность к росту, размножение и даже высшую форму движения материи – мышление.
Белок — строительный материал для организма
Важным элементом рационального питания служит его белковая полноценность. Проявление в организме биологических свойств различных компонентов пищи, особенно витаминов, происходит наиболее полно только на фоне достаточного белкового питания. Процессы синтеза в организме также находятся в зависимости от уровня белкового питания. Так, синтез фосфатидов, играющих важную роль в нормализации жирового и холестеринового обмена, ограничивается или полностью прекращается при недостатке белков в питании.
В организме человека постоянно отмирает и распадается множество клеток. Для того чтобы построить новые клетки взамен старых, опять-таки нужен строительный материал, и прежде всего белок. Из белка строится не только цитоплазма клеток, но и ферменты гормоны и другие биологически активные вещества, регулирующие обмен веществ.
Так, недостаток белка в питании приводит к резкому отставанию развития ребенка и значительным нарушениям в здоровье взрослых: падает трудоспособность, понижается сопротивляемость организма к простудным и инфекционным заболеваниям.
Хотите больше информации по вопросам диетологии?
Приобретите информационно-практический журнал «Практическая диетология» в электронном или печатном формате!
Источник https://foodandhealth.ru/komponenty-pitaniya/belki/
Источник https://fb.ru/article/259735/v-chem-zaklyuchaetsya-stroitelnaya-funktsiya-belkov
Источник https://praktik-dietolog.ru/article/46.html