ГМО и другие генетические тайны селекции растений
Уже давно растениеводство во всем мире радуется многочисленным подаркам генной инженерии – устойчивым к вредителям и холоду, быстрорастущим и продуктивным растениям, однако для среднестатистического потребителя метка «ГМО» сегодня сродни печати Каина. Почему так? Один ответ лежит на поверхности: генные инженеры делают сегодня то, чего природа не смогла бы сделать никогда или, по крайней мере, очень нескоро, что не только впечатляет, но и пугает. Людей настораживает и то, что сами создатели ГМО не торопятся полностью исключать риск возможных негативных последствий их распространения. С другой стороны, согласно свежим опросам «Левада-центр», всего лишь 30 % россиян точно знают, что гены содержатся во всех растениях, а не только в генетически модифицированных, поэтому тотальная ГМО-боязнь во многом вызвана тотальной «генетической» безграмотностью. Между тем спектр современных методов селекции новых сортов растений очень широк, а среди разрешенных есть не менее рискованные и/или практически неизвестные широкой общественности подходы
ГМО расшифровывается как генетически модифицированный организм, что подразумевает то или иное воздействие на геном растений – хранилище наследственной информации, «святую святых» живых клеток. Сегодня большинство новейших методов селекции растений тяготеют к внесению изменений непосредственно в структуру ДНК. В результате, по определению ВОЗ, мы и получаем ГМ-растения – новые сорта, которые не могли образоваться в природе в результате размножения или естественной рекомбинации («перемешивания генов»).
Все это так, но в изменении генома растений на самом деле нет ничего нового и революционного! Человек всегда так или иначе оказывал влияние на генетику растений, которые выращивал, хотя и понятия не имел о генах.
Путь к современным культурным растениям, которые мы употребляем в пищу, начался примерно 10 тыс. лет назад, когда появилось сельское хозяйство. Человек выбирал самые здоровые и пригодные для еды растения и планомерно их выращивал. В сельском хозяйстве нет места закону естественного отбора: согласно закону человека (искусственному отбору), выживает только то растение, которое отвечает его запросам.

В современной истории селекции есть две особенно значительные вехи. Первая – открытие Г. Менделем в конце XIX в. законов наследования, в результате чего появились понятия гибридизации (скрещивания) и отбора. Вторая – открытие структуры ДНК Д. Уотсоном и Ф. Криком в 1953 г. и появление центральной догмы молекулярной биологии, описывающей пути хранения, воспроизведения и передачи генетического материала в живых организмах.
Позднее были обнаружены способы прямого воздействия на ДНК: в 1960-х гг. – путем провоцирования мутаций, в 1983 г. – с помощью искусственно созданной ДНК. Тем не менее традиционные методики селекции, такие как скрещивание, хотя и претерпели значительные изменения, продолжают применяться на равных с новейшими методами. Именно разнообразие подходов дает современным селекционерам эффективный набор инструментов, с помощью которых они могут «по заказу» создавать растения будущего
Ярким примером расхождения целей естественного отбора и селекции служит кукуруза. У предка этого злака зерна при созревании легко отделялись от початка и падали на землю. Такая кукуруза прекрасно размножалась, но человек неизбежно терял большую часть урожая. Что же мы видим теперь? Ядра современной кукурузы на момент зрелости прочно прикреплены к початку. Так же обстоит дело и с другими зерновыми культурами – рисом, ячменем, пшеницей.
Все эти новые виды культурных растений, по сути, являются результатом модификации генома разными способами, например, путем скрещивания разных сортов, что приводит к появлению совершенно новых культурных форм. Огромный материал для искусственного (так же как и для естественного) отбора предоставляет природный мутационный процесс. Ведь спонтанные мутации (изменения) в ДНК растений происходят постоянно, например, в результате действия солнечного излучения. И если такая мутация приводит к появлению особей с заметными положительными отличиями, их остается только тиражировать – вот и вся селекция. Примером служит большое разнообразие современных овощей семейства крестоцветных: брокколи, цветная и белокочанная капуста происходят от одного общего предка (Kempin et al., 1995).
Дальше – больше. За последние 80 лет люди получили более 3 тыс. новых сортов растений, воздействуя на исходные формы излучением или химическими реагентами, чтобы вызвать непредсказуемые мутации в ДНК. Растения, полученные в результате такого искусственно вызванного ненаправленного мутагенеза, успешно возделывают и поныне. Более того, как это ни парадоксально, они никогда не считались ГМО. Впоследствии в обществе распространилось крайне ошибочное мнение, что первые генетически модифицированные растения появились лишь в результате использования методов генной инженерии, целенаправленно воздействующих на ДНК.
В любом случае оценивать новый сорт следует исходя из его характеристик, а не того или иного пути селекции. А чтобы составить собственное мнение об опасности ГМО, нужно как минимум понимать, откуда они берутся.
Рецепт ГМО: режь, исправляй, сшивай
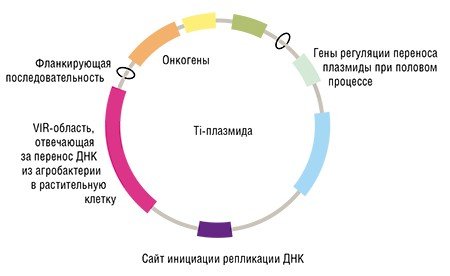
Так как же сделать ГМО из обычного растения? Рецепт довольно прост. Возьмите геном растительной клетки и добавьте в него «генетическую конструкцию» – последовательность ДНК, кодирующую производство нужного белка. Доставить ген можно с помощью вектора – молекулы ДНК или РНК, способной «размножаться» и переносить чужеродный наследственный материал из клетки в клетку. Таким образом можно добавить сразу несколько генов, например, с помощью вектора на основе кольцевой бактериальной плазмиды.
На первый взгляд все просто, если не задумываться о том, как вставить новый генный фрагмент именно в тот участок ДНК растительной клетки, который нам нужен. А ведь в этом и заключается самая сложная задача редактирования генома, результатом которого являются современные ГМО.
Для того, чтобы расщеплять молекулы ДНК в точно заданных участках, сначала стали использовать рестриктазы – ферменты-«ножницы», способные узнавать определенные последовательности нуклеотидов (строительных блоков ДНК). Функцию сшивки ДНК-цепи исполняли другие ферменты – ДНК-лигазы, призванные исправлять (репарировать) повреждения в структуре ДНК.
Сегодня, как и 30—40 лет назад, эти методы активно используют для получения новых вариантов бактериальных и вирусных геномов. А вот для успешной работы с геномами высших организмов (таких как растения, животные и мы с вами) этих инструментов оказалось недостаточно. Дело в том, что рестриктазы способны узнавать лишь короткие последовательности ДНК, что вполне достаточно для эффективного расщепления коротких ДНК-цепей бактерий, где такие участки встречаются нечасто. Но геномы высших организмов содержат огромное множество коротких последовательностей нуклеотидов, узнаваемых рестриктазами, поэтому «прицельность» метода оказывается очень плохой.
Для редактирования таких геномов пришлось создавать свои инструменты точечного воздействия на ДНК: сначала олигонуклеотид-направленный мутагенез растений, затем сайт-направленный мутагенез с использованием ферментов-нуклеаз с «цинковыми пальцами», TALENs-нуклеаз и даже мегануклеаз (Закиян, 2014; Daboussi, 2015). Но лишь с открытием в 2012—2013 гг. знаменитой технологии CRISPR/Cas9 ученые вплотную подошли к точному исправлению или редактированию генов и геномов (Cong, 2013). Возможность вносить контролируемые изменения в наследственную информацию живых клеток стала настоящим прорывом и повлекла за собой глобальные изменения в селекции.
Насколько остры генетические ножницы?
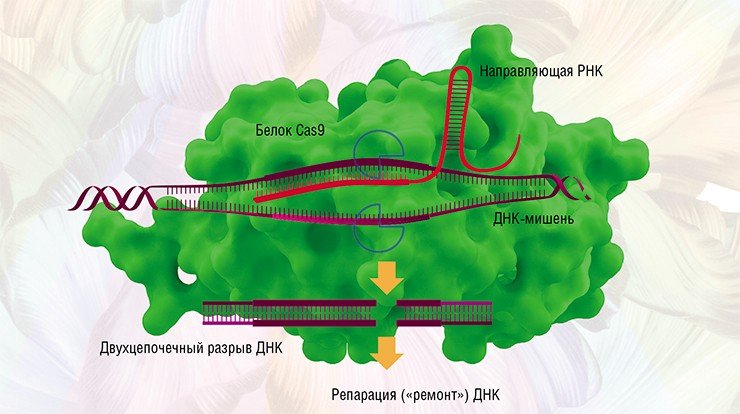
Основой системы CRISPR/Cas9 стал своеобразный молекулярный механизм, с помощью которого бактерии защищаются от бактериофагов (бактериальных вирусов). При проникновении патогенного вируса в бактерию запускается «иммунная» реакция, приводящая к расщеплению чужеродной генной последовательности. Это делает белок-«ножницы» Cas после того, как захватчик распознан по генному «портрету» – фрагментам вирусной ДНК, хранящимся в участке CRISPR бактериального генома.
На основе бактериальных CRISPR/Cas-систем ученые создали упрощенные искусственные молекулярные конструкции, включающие белок Cas9 и обеспечивающие невероятную точность при разрезании цепей ДНК (Закиян, 2014). С их помощью стало возможным проводить все виды модификаций генома: вносить точечные мутации, встраивать, исправлять, заменять или удалять крупные ДНК-последовательности и фрагменты выбранных генов.
С помощью системы CRISPR/Cas9 уже внесены точные модификации в геном множества растений, в частности, получены новые сорта риса, устойчивые к поражению гнилью, вызываемой фитопатогенными бактериями Xanthomonas, а также знаменитый «золотой рис», содержащий ген бета-каротина (Chen, Gao, 2013). Была решена и нетривиальная задача – создание растений-«биофабрик», способных синтезировать белки человека: инсулин, необходимый для больных сахарным диабетом, и альбумин, применяемый при лечении ожогов и цирроза.

Но несмотря на подтвержденную эффективность системы CRISPR/Cas9 все еще остается риск неспецифичного воздействия на ДНК и нарушения последовательности кодирующих генов. Неудивительно, что настоящий взрыв в мировом сообществе вызвала публикация китайских ученых из Университета Сунь Ятсена (КНР), несколько лет назад впервые применивших CRISPR/Cas9 для исправления генома эмбрионов человека с целью лечения генетического заболевания талассемии. При этом лишь для 4-х из 86 подопытных оплодотворенных яйцеклеток удалось достичь положительного результата (Liang et al., 2015).
На пути развития технологий, использующих принципы синтетической биологии, еще остается множество социальных барьеров, несмотря на то, что современные ГМ-продукты обладают высоким уровнем безопасности. В свое время большой резонанс вызвали справедливо оспариваемые статьи о развитии раковых опухолей у крыс и гибели бабочек, спровоцированных использованием ГМО (Walker, 2006). В результате общенациональный опрос в США, проведенный Hart Research Associates в 2010 г., показал, что не более 10 % людей не связывают генную инженерию с угрозой биотерроризма, нанесением вреда окружающей среде и здоровью человека, а также не считают создание искусственной жизни чем-то аморальным. В то же время анализ общественного мнения в Великобритании показал, что более половины населения признает полезность новых биотехнологий для общества, несмотря на сопряженный с ними экологический риск (Philp et al., 2014). Об уровне биологического образования в России можно судить по опросу, проведенному в 2015 г. в Казани, где 55 % горожан высказались за полный запрет ГМО, при том что лишь 15 % респондентов честно признались, что затрудняются сказать о том, что такое ГМО, а большая часть (48 %!) предложили изъять из продажи «любые пищевые продукты, содержащие гены» (Бизнес Online, 2015). Если учесть, что «гены» имеются в клетках всех живых организмов, включая бактерии, то таких борцов ожидает безрадостное гастрономическое будущее: крахмал с маслом на первое и сахар с соком на второе, ведь даже в обычном молоке присутствуют соматические клетки со своим генным содержимым
Сегодня ряд специалистов призывают к мораторию на любые эксперименты, связанные с редактированием генов человеческих эмбрионов или половых клеток. Их опасения можно понять: когда речь идет о геноме человека, успех должен быть гарантирован. И все же прогресс не остановить: недавно Великобритания стала второй страной, где исследователям было позволено проводить подобные эксперименты (Ершов, 2016).
Тем не менее страх человека перед вмешательством в геном живых организмов не только не убывает, но и в некоторых случаях даже продолжает расти. Вследствие этого оборот и потребление продуктов геномного редактирования растений строго контролируются на законодательном уровне, что препятствует переходу мирового сельского хозяйства на использование продвинутых методов селекции. Однако ученые не сдаются и предлагают сократить до минимума и даже исключить возможные риски негативных последствий введения новых генов в организм растений.
Снижаем риски: от ТРАНС к ЦИС и ниже
Сейчас прохождение всех тестов на биобезопасность и вывод на рынок генетически модифицированных организмов, в том числе растений, жестко регулируется на международном уровне. В этом вопросе правовая база ЕС опирается на директиву Европейского парламента и Совета Европейского союза от 12 марта 2001 г. «О преднамеренном выпуске в окружающую среду генетически модифицированных организмов». Примечательно, что данный нормативный документ исключает из перечня ГМО организмы, полученные путем скрещивания, экстракорпорального оплодотворения, полиплоидной индукции, возникновения мутаций и слияния протопластов скрещиваемых видов (соматическая гибридизация).
Законодательство РФ в области ГМО растительного происхождения регулируют 4 федеральных закона и 6 постановлений Правительства РФ, в том числе федеральный закон № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» от 5 июля 1996 г. Ожидается вступление в силу постановления, позволяющего узаконить возделывание ГМ-культур на территории России, которые пока можно выращивать только на опытных участках. Для ввоза в нашу страну сегодня разрешены 22 линии пищевых и кормовых ГМ-растений, среди которых кукуруза, картофель, соя, сахарная свекла и рис, а любые ГМО и ГМ-продукты должны проходить обязательную регистрацию.
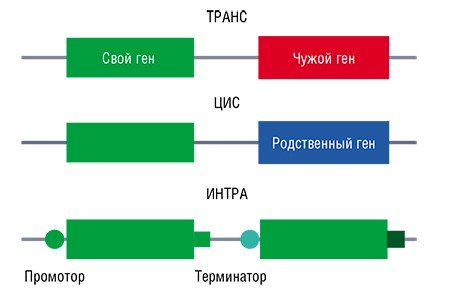
В свою очередь, мировое ученое сообщество считает, что нужно различать ГМО по способу получения и делать послабления для продуктов, полученных умеренным вмешательством. Так появилась система деления ГМО на три вида: ТРАНС, ЦИС и ИНТРА.

Трансгенными сегодня называют организмы с искусственно введенными генами, которые в принципе не могут быть приобретены путем естественного скрещивания. Это могут быть гены растений других видов или животных, например рис, в геном которого встроен ген кукурузы. Потенциальная опасность трансгенных культур в том, что приобретенные таким образом новые качества могут повлиять на пригодность к использованию в пищевых или кормовых целях, а затем передаться диким родственникам, что может иметь непредсказуемые последствия для природных экосистем. По этой причине законодательные и регулирующие органы развитых стран уделяют большое внимание биобезопасности таких культур, чтобы снизить риск экологических сдвигов.
В геном цисгенных растений могут быть введены гены организмов того же или близких видов, с которыми возможно скрещивание в естественных условиях. При этом сам целевой ген не должен быть видоизменен или оторван от своих регуляторных последовательностей. Пример цисгенного растения – картофель, не подверженный картофельной гнили благодаря встраиванию генов диких видов картофеля из Анд, устойчивых к этому заболеванию. Такой картофель сейчас создается в Бельгии (VIB’s fact series, 2015). Важно, что цисгенезис не привносит в организм растения принципиально новых для него признаков и, по сути, аналогичен традиционному скрещиванию с родственными дикими формами.
Интрагенезис можно считать продолжением концепции цисгенезиса, но в этом случае в ДНК растения встраивают его собственный ген, совмещенный с регуляторными участками других его генов. В ходе такой модификации искусственно создаются новые комбинации из уже имеющихся в растении участков ДНК (Holme, 2013). Подобное изменение регуляции активности генов позволяет усиливать полезные признаки (например, способность накапливать витамины в листьях) или, напротив, устранять или сводить к минимуму нежелательные.
Между тем при современном регулировании оборота ГМО-различия между трансгенными и цисгенными растениями не учитываются, хотя эти типы кардинально различаются. Из-за жестких рамок, установленных законодательством, получение и использование цисгенных растений серьезно затруднено, что может заблокировать или значительно отсрочить проведение дальнейших исследований по улучшению сортов сельскохозяйственных культур. Пока лишь в Канаде контроль за цисгенными растениями менее строг по сравнению с трансгенными (Schouten, 2006).
Соматический Франкенштейн
Интересно то, что в мощной законодательной «обороне» против ГМО оказались бреши, появившиеся благодаря ряду парадоксов и допущений, которые на руку смелым селекционерам. Один из примеров – соматическая гибридизация. Другими словами, формирование новых форм растений путем комбинирования ядерных и других (митохондриальных и пластидных) генов при культивировании и слиянии обычных соматических клеток, составляющих ткань растения и не принимающих участия в половом размножении. Этот тип гибридизации растений достаточно широко распространен, при этом на территории ЕС такие соматические гибриды не считаются ГМО. Соответственно их оборот не подвергается строгому контролю.
Что же это за волшебный способ селекции? На первом этапе клетки растений двух разных видов (как правило, культурного и дикорастущего) обрабатывают специальными агентами, разрушающими клеточную оболочку, чтобы получить протопласты. Далее химическим или механическим способом провоцируют слипание и слияние протопластов, которые в дальнейшем восстанавливают общую клеточную оболочку. В результате из двух и более «родительских» клеток образуется новый живой организм – регенерант, или соматический гибрид.
Судьба родительских геномов при этом может быть различной. Два ядра могут синхронно делиться без слияния, образуя двуядерные дочерние клетки. Если же они сольются во время митотического деления, то в итоге получатся устойчивые одноядерные дочерние клетки, несущие смешанный генетический материал. Что касается внеядерного генома, то он тоже может быть получен как от одного родителя, так и быть смешанным. С помощью соматической гибридизации можно получать самые разные гибриды, включая такие, создание которых в принципе невозможно половым путем: например, гибриды, несущие цитоплазматические гены не от материнского растения, а от обоих родителей; «цибриды», содержащие ядро от одного из родителей, а цитоплазму от другого, и др.

Использование соматических клеток при гибридизации позволяет успешно работать с отдаленными, обычно нескрещиваемыми видами и полностью стерильными растениями. Иными словами, этот метод используют, если возникает необходимость преодолеть несовместимость культурных и дикорастущих видов. Таким способом можно получать межклассовые гибридные клеточные колонии: рис + соя, ячмень + табак и даже табак + мышь (Makonkawkeyoon, 1995)! Правда, большинство таких регенерантов сами размножаться уже не способны, а иногда и вовсе представляют собой скорее скопление клеток, чем полноценный организм.
Интересно, что, хотя метод соматической гибридизации влечет за собой значительную «перетасовку» генов, а его результаты очень непредсказуемы, он, тем не менее, разрешен для использования в сельском хозяйстве, в отличие от методов направленного мутагенеза. Как говорила Алиса в Стране чудес, «чем дальше, тем страньше».
Что скрывается под прививкой
А теперь пришло время обратиться к методам, которые должны удовлетворить стандарты даже самых ярых приверженцев натуральных продуктов. Ведь методы эти используются уже очень давно, и они не встречают общественного или законодательного сопротивления. Но оказывается, что с точки зрения генетики эти методы вовсе не «безгрешны», а их комбинация с новейшими подходами открывает перспективы, о которых вы, возможно, и не подозревали.
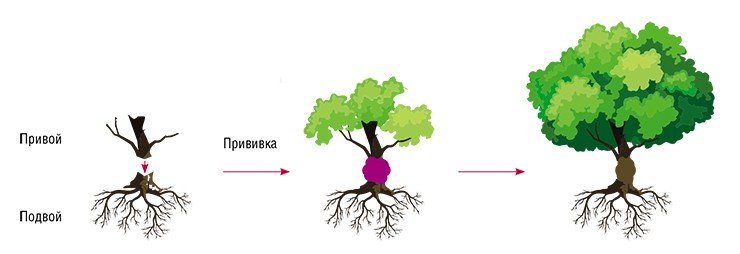
Например, давно известным способом размножения растений, с которым повсеместно сталкиваются садоводы-любители, является прививка. Суть ее в том, что стебель одного растения (привой) пересаживают на корень другого (подвой). В конце XIX в. этот метод помог спасти европейские сорта винограда Vitis vinifera от нашествия насекомого филлоксеры, повреждающего корни. Прививку осуществляли на североамериканский виноград Vitis labrusca, устойчивый к этому вредителю (Трошин, 1999). А в 2003 г. фермер из Орегона Р. Баур с помощью прививки получил настоящий «томак» (томат + табак), совсем как у Гомера из популярного американского мультсериала «Симпсоны». Пробы показали наличие в томаке никотина, правда, только в листьях, а не в плодах (Philipkoski, 2003).
Что же происходит с растением в результате прививки, если геномы подвоя и привоя не меняются? Во-первых, у подвоя могут увеличиваться или уменьшаться сила роста, размер плодов, сроки созревания. При этом новые признаки не передаются потомству в случае размножения семенами, так как не являются наследственными. Во-вторых, в результате использования прививки возможны «химерные» изменения, и в итоге привитое растение будет состоять из генетически разнородных клеток. Этот эффект также не наследуется. Его часто используют в декоративном цветоводстве и садоводстве для получения растений с мозаичной окраской листьев или соцветий.
В ходе прививки возможно и появление настоящих мутаций, спровоцированных специфическими веществами (этилметансульфонатом, этилимином и др.), которые поступают к привою от подвоя. Однако частота появления мутаций после прививок крайне низка. Неоспоримым преимуществом прививок является возможность размножать мутации, не передающиеся по наследству, а основным недостатком – большой объем исходного материала.
Прививка растений – это, безусловно, метод проверенный и безопасный. Но что произойдет, если в качестве подвоя использовать растение, перенесшее генетическую модификацию? Будет ли полученное растение ГМО? Оказывается, нет: согласно законам плоды таких гибридов не входят в перечень ГМО, так как ДНК привоя остается неизмененной. Однако мы не можем быть уверены в том, что никакого обмена наследственной информацией между привоем и подвоем не происходит. К примеру, от корневища к привою могут перейти молекулы РНК, регулирующие работу генома, а это означает, что нельзя предсказать и уровень производства тех или иных белков в привитом растении.
Берем генетический разбег!
Но прививка – это далеко не единственный окольный путь для создания новых сортов с измененной активностью ДНК. Ускоренное скрещивание деревьев и кустарников (fast-track breeding) – это даже не метод, а целый комплекс методик, направленных на сокращение сроков получения новых сортов, что особенно важно для многолетних культур. Ведь цикл размножения деревьев с крупными плодами (например, ореха или сливы) может доходить до 10 лет и более (van Nocker, 2014). Это означает, что после посадки первого гибрида селекционер вынужден ждать 5—10 лет, пока тот вырастет и повзрослеет, чтобы продолжить работу. Если же необходимо провести несколько последовательных скрещиваний, выведение нового сорта дерева может занять и 30 лет. В современных условиях никто не готов столько ждать.

Чтобы максимально ускорить процесс, ученые давно поливают своих подопытных гормонами роста, выращивают их при высоких температурах и прибегают к другим уловкам, таким как ДНК-технологии. Среди безобидных можно отметить маркер-вспомогательный отбор, который заключается в анализе генома новых ростков или даже семян и отборе лучших гибридов задолго до того, как они превратятся во взрослые растения. Теперь растение уже не нужно обрабатывать патогеном, чтобы понять, насколько оно к нему устойчиво, достаточно найти нужный ген в семечке. Основной недостаток такой селекции – ее высокая стоимость, поскольку скрининг ДНК – вещь недешевая.
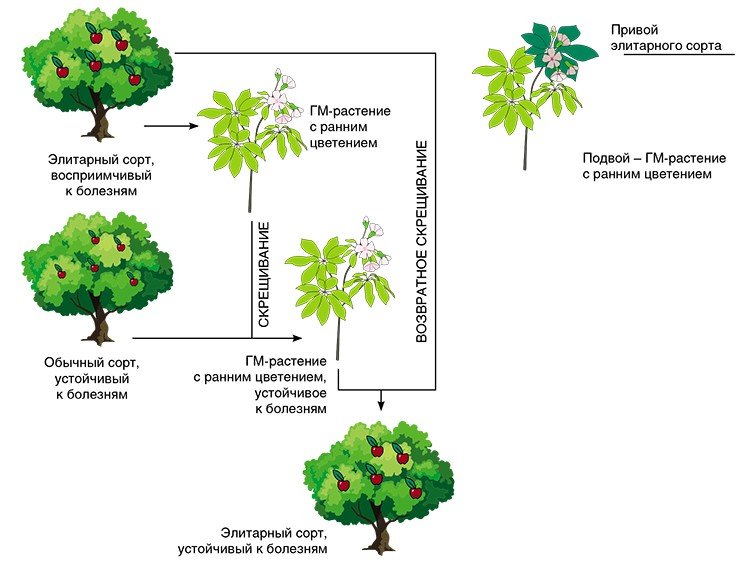
Чтобы растение быстрее повзрослело, селекционеры иногда хитрят. Например, искусственно активируют гены, отвечающие за запуск механизма размножения, после чего начинает цвести и приносить плоды совсем молодое растение. Иногда в геном дерева вводят дополнительные гены, которые ускоряют процессы цветения и плодоношения, и время ожидания первого цветения саженцев сокращается до 1 года. При сочетании методик ускоренного и возвратного (когда гибрид скрещивают с одним из родителей) скрещиваний ген быстрого цветения можно сначала ввести в исходный сорт, а на последнем этапе селекции удалить его путем скрещивания генетически измененного гибрида с родительским растением.
Ускоренное скрещивание осуществляют также путем прививания на ГМ-подвой. Секрет в этом случае кроется в генетически измененном корневище, в котором активно работают гены, отвечающие за цветение. В результате из корневища к листьям поступают специфические белки, запускающие механизм взросления, и привой начинает цвести.
Таким образом, современные методы прививки и ускоренного скрещивания растений за внешней традиционностью таят в себе много настоящих генетических секретов. В то же время ученые, сталкиваясь с общественным мнением и жестким регулированием распространения ГМО, все чаще пытаются избежать внесения изменений непосредственно в растительную ДНК. И здесь мы вплотную подходим к самой загадочной группе современных методов селекции.
Эпигенетика: чуть-чуть не считается
Одними из самых молодых и суперсовременных альтернатив для селекционеров стали подходы эпигенетики – науки о наследуемых механизмах управления экспрессией генов (Marjori, 2015). Как работает наш генетический код, общеизвестно, но вот тонкости его надстройки (эпи- означает «над»), своего рода «дирижера», управляющего работой генома, во многом остаются загадкой.
Начало производства белков в клетке регулируется множеством факторов. У клетки также имеются приемы, заставляющие «замолчать» тот или иной ген, чтобы предотвратить производство уже ненужного белка: это и разрушение еще незрелых молекул РНК, считанных с генетической «матрицы», и создание «механических» препятствий для самого считывания ДНК (Marjori, 2014). В общем, эпигенетических сигналов в клетке очень много, они не до конца изучены, однако некоторые из них уже используются для селекции растений, которые попадают к нам на стол каждый день.

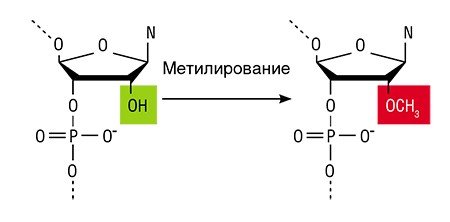
Подавить работу генов в клетке можно с помощью природного механизма – РНК-зависимого ДНК-метилирования, суть которого состоит в присоединении метильной группы (СН3) к нуклеотиду цитозину, стоящему в определенном положении. В результате блокируется процесс считывания информации с ДНК на молекулу РНК (Zhang, 2013).
Метилирование ДНК у растений и животных осуществляется ферментами ДНК-метилтрансферазами. Сами по себе эти ферменты метилировать ДНК не могут: им нужны специальные некодирующие РНК, которые направляют метилтрансферазы к конкретным участкам ДНК. Более того, считается, что в метилировании ДНК участвуют еще два вида РНК: малые интерферирующие РНК и микроРНК. Все вместе эти молекулы и определяют, какой именно участок ДНК цепи нужно метилировать. Сегодня такие РНК можно ввести в растение с помощью разных методик, например, посредством вирусов растений или с помощью техник генной инженерии (Deng, 2014).
Интересно, что если ученый изменяет признак растения с помощью ДНК-метилирования и при этом не вносит в геном никаких мутаций, то такое растение не считается ГМО. Если же некодирующие РНК не вводятся извне, а производятся самим растением благодаря геномному редактированию, то оно уже относится к генно-модифицированному.

Но и тут можно схитрить. Дело в том, что у растений метилирование определенных областей ДНК может наследоваться, т. е. передаваться от родителей к следующим поколениям (Jones, 2001). Благодаря ряду скрещиваний ГМ-растения с его природной формой можно получить гибрид, у которого нет измененной ДНК, но метилирование сохраняется. Такой гибрид уже не будет считаться генетически модифицированным.
Насколько метилирование безопасно? Достаточно, ведь метильные группы присоединяются к ДНК совсем не в случайных местах. Поэтому, в отличие от традиционных методов селекции, результаты такого воздействия предсказуемы: мы можем заранее выбрать ген, кодирующий определенный белок, и просто заставить его замолчать. Но делать это нужно аккуратно, так как механизмы метилирования ДНК довольно сложны. Иначе в результате мы можем получить растение, подверженное болезням или преждевременному старению.
Иногда ДНК-метилирование, наоборот, является обязательным условием для начала работы гена. Ученые и это научились использовать: с помощью изменения метилирования ДНК можно увеличить активность генов, отвечающих за производство растением запасных белков. Например, регулируя метилирование, можно повысить содержание белков в зерне пшеницы, а путем обработки риса ингибитором метилирования (5-азацитидином) – получить растения с наследуемым признаком карликовости (Ванюшин, 2013).
Молчание РНК как заслон от аллергии
Успешное считывание гена на матричную РНК вовсе не означает, что кодируемый им белок будет построен: эта мРНК может быть разрушена в цитоплазме клетки. Такое явление, названное посттранскрипционным молчанием, часто наблюдается при внесении дополнительных генов в ДНК растений. Впервые оно было описано еще в 1990 г., когда при введении в геном петунии дополнительных копий гена, отвечающего за красную окраску цветков, количество красного пигмента не только не возросло, но и значительно снизилось (Napoli et al., 1990).
Механизм «замолкания РНК» снижает эффективность работы генных инженеров. С другой стороны, его можно использовать для создания растений, устойчивых к растительным вирусам, так как он может способствовать разрушению не только их собственных матричных РНК, но и соответствующих РНК вирусов, которым удалось проникнуть в клетки растений.

Судя по всему, механизмов посттранскрипционного молчания существует несколько, и ученые пока не вполне понимают, как они работают и как связаны между собой, белые пятна в этой области только начинают заполняться (Плотников, 2007). Есть предположение, что отдельные молекулы мРНК активно деградируют при достижении определенного порога своей численности (Abler, 1996). Другая теория основана на изменениях в регуляции работы генома, связанных с метилированием ДНК, в результате чего среди нормальных РНК синтезируется некоторое количество «ненормальных», которые и запускают распад мРНК в цитоплазме (Hoofvan, 1997).
Одним из хорошо описанных механизмов посттранскрипционного молчания является РНК-интерференция. Этот метод базируется на способности молекул двухцепочечных РНК эффективно подавлять активность сходных с ними по строению генов. В последние годы РНК-интерференцию используют в прикладных исследованиях, направленных на получение нокаутных (содержащих «молчащие» гены) клеток, тканей и организмов. Ведь если грамотно использовать этот механизм, то теоретически можно «выключить» в клетке производство любого белка.
Среди успешных примеров применения этого метода – получение двух сортов кофейного дерева, содержащих в плодах пониженный на 30—50 % алкалоид кофеина. Схожий эксперимент был проведен и с табаком с целью понизить в растении содержание никотина (Рябушкина, 2009).
Другая возможность использования этого подхода – подавление синтеза аллергенов. И это уже не сказка: генетикам из испанского Института сельского хозяйства в Кордове почти полностью удалось освободить зерна пшеницы от глиадина – одного из составляющих глютена. Именно из-за глиадина группа запасающих белков пшеницы вызывает у многих людей иммунную реакцию. Правда, и без использования системы редактирования генома CRISPR/Cas9 тут не обошлось (Sanchez-Leon et al., 2017).

Конечно, в этом направлении ученым еще работать и работать, но уже есть надежда, что совсем скоро можно будет смело есть арахисовое масло без боязни умереть от анафилактического шока! Важно отметить, что подобное вмешательство генной инженерии в метаболизм растений отличается от традиционного: в геном не встраивается чужеродный ген, а значит, не происходит и синтеза чужеродного белка. Из-за этого РНК-интерференцию можно назвать генным вмешательством со сниженным экологическим риском. Более того, даже формально такое вмешательство не несет на себе печати «ГМО».
Каков же итог нашей экскурсии по современным методам селекции? Шанс сделать выбор в пользу «натуральных» злаков, овощей и фруктов мы давно упустили. Прогресс, в том числе и в создании новых видов растений, остановить невозможно, но осознавать и правильно оценивать риски распространения и употребления генетически модифицированных продуктов необходимо.
Сегодня, когда общество проявляет большую озабоченность безопасностью пищевых продуктов, селекционеры находятся в ситуации, вынуждающей их использовать альтернативные пути получения новых сортов растений. В силу тех или иных причин эти методы не относятся к запрещенным, но в ряде случаев являются не менее рискованными, чем традиционные методики получения ГМО.
Также не стоит забывать, что грамотный подход к селекции растений с использованием техник редактирования генома позволяет минимизировать использование пестицидов и удобрений – что это означает для экологии, нет нужды объяснять. В любом случае, какие продукты мы будем есть завтра, в огромной степени зависит уже не от природы, а от нас самих.
Закиян С. М., Власов В. В., Медведев С. П. «Редакторы геномов»: от «цинковых пальцев» до CRISPR // НАУКА из первых рук. 2014. Т. 56. № 2. С. 44—53.
Шумный В. К. Природа была первым генным инженером // НАУКА из первых рук. 2004. Т. 2. № 3. С. 32—39.
Cong L., Ran F. A., Cox D. et al. Multiplex Genome Engineering Using CRISPR/Cas Systems // Science. 2013. V. 339. P. 819—823.
From plant to crop: the past, present and future of plant breeding. 2016. VIB’s fact series, 44 p.
Philp J. C., Ritchie R. J., Allan J. E. Synthetic biology, the bioeconomy, and a societal quandary // Trends in Biotechnology. 2013. V. 31. P. 269—272.
Moghaddassi S., Eyestone W., Bishop C. E. TALEN-Mediated Modification of the Bovine Genome for Large-Scale Production of Human Serum Albumin. 2014, PLoS ONE. 9, e89631.
Matzke M. A., Kanno T., Matzke A. J. M. RNA-Directed DNA Methylation: The Evolution of a Complex Epigenetic Pathway in Flowering Plants // Annu. Rev. Plant Biol. 2015. V. 66. P. 243—267.
Публикация подготовлена на основе статьи, которая участвовала в научно-популярном конкурсе «био/мол/текст»-2017 портала «Биомолекула» (biomolecula.ru)
Как выводятся новые сорта плодовых растений
В нескольких номерах журнала «Амурский садовод» мною было не мало рассказано о различных сортах плодовых и ягодных культур, подробно описаны их основные хозяйственные характеристики, отличия и потенциальные возможности. Описывая их, я старался рассказать об особенностях амурских и инорайонных сортов, объяснить причины, по которым невозможно возделывать множество сортов фруктовых деревьев и ягодных кустарников в открытозимующей форме в условиях Приамурья.
Читая эту информацию, наверняка у множества садоводов возникает вопрос – почему в Амурской области нет сортов плодовых и ягодных культур, которые были бы схожи по крупноплодности к примеру с алтайскими сортами? Или почему нельзя вывести сорт груши или яблони с размерами плодов, не уступающим привозным китайским или аргентинским? И, наконец, как вообще выводятся сорта плодовых?
Вывести такие сорта можно, но для этого требуется очень много времени и больших затрат труда. А вот каким образом происходит выведение новых сортов я и постараюсь ответить в этом номере.
Для начала расскажу, что представляет собой сорт плодового растения.
Все сорта плодовых и ягодных культур в генетическом отношении являются клонами. В селекции существует даже такое понятие «сорт-клон» — совокупность растений, обладающих комплексом хозяйственно-полезных качеств, передающихся при вегетативном размножении. Вегетативное размножение это размножение усами (у земляники), корневыми отпрысками (малина), черенками и отводками (смородина, крыжовник, жимолость), делением куста (безусая земляника, смородина), прививкой (груша, яблоня, абрикос, слива). Если вы попытаетесь размножить какой-либо сорт при помощи семян, то он либо не воспроизведет себя полностью, либо потеряет какие-то отдельные качества (вкус, размер плодов или ягод, зимостойкость), да и назвать сортом полученное растение уже будет нельзя. С чем же это связано?
Чтобы ответить на этот вопрос необходимо разобраться, как выводятся сорта плодовых культур, из каких основных этапов состоит селекционная работа.
Создание модели будущего сорта
Прежде чем приступить к выведению нового сорта необходимо определить его параметры, создать модель.
Модель сорта – это тот идеал, который представляет каждый любитель фруктов и ягод, то есть, что именно хотел бы видеть обычный потребитель. Обычно это желание видеть в своем саду или на полке в магазине красивые, долго не портящиеся фрукты, богатые витаминами и очень приятные на вкус. Однако, для селекционера, ориентирующегося на потребителя, добавляется еще несколько показателей: сроки созревания — для увеличения продолжительности снабжения рынка; продуктивность – для повышения эффективности производства; зимостойкость, засухоустойчивость, устойчивость к болезням и вредителям и другие показатели.
Создавая модель сорта, селекционер определяет его основные параметры и уж затем приступает к следующему этапу.
Подбор родительских форм
Чтобы создать сорт, необходимо подобрать родительские формы, которые послужат генетической основой для будущего сорта. Подбор родительских форм это очень трудоемкий процесс, который иногда занимает не один год. В основном это связано с тем, что необходимо время на то, чтобы найти нужную форму, размножить ее вегетативно, высадить в коллекцию, дождаться плодоношения, а не редко и изучить в течение двух-трех лет.
В качестве родительских форм могут привлекаться уже существующие сорта (как местные, так и инорайонные), обладающие комплексом хозяйственно-полезных качеств. Чаще всего инорайонные сорта используются для улучшения каких-либо отдельных признаков (например, крупноплодности).
Не редко в селекции используются в качестве родительских форм те гибридные формы, которые были поучены ранее в селекционном процессе, но по разным причинам не смогли стать сортами (низкая зимостойкость, высокая осыпаемость плодов, резкая периодичность плодоношения и др.). У таких форм могут быть отдельные признаки, которые они смогут передать своему потомству и уже в нем проявиться в сочетании с другими показателями.
В качестве исходного материала также могут использоваться дикорастущие представители местной флоры (сибирская ягодная яблоня, уссурийская груша, маньчжурский абрикос, дикорастущие виды черной смородины и др.). Достоинством диких форм является их высокая способность противостоять комплексу неблагоприятных условий, высокая устойчивость к грибным, бактериальным и вирусным заболеваниям, высокое содержание органических кислот и витаминов в плодах.
После того, как определены родительские формы, селекционер приступает к следующему этапу селекционного процесса – гибридизации.
Гибридизация
Гибридизация, или скрещивание – это процесс объединения наследственности двух родительских форм, а также форм предыдущих поколений.
Процесс гибридизации относительно не сложен и его может провести даже любитель хотя бы немного знакомый со строением цветка. Цветок большинства плодовых культур (за исключением облепихи) содержит в себе как мужскую часть (тычинки), так и женскую (один или несколько пестиков). На вершине тычинки (в пыльнике) созревает пыльца, каждое пыльцевое зерно несет в себе два спермия. В основании пестика (в завязи) созревает одна или несколько яйцеклеток. При опылении пыльцевое зерно попадает на рыльце пестика (его вершину), там оно прорастает – вытягивается пыльцевая трубка, идущая до самого семязачатка, по пыльцевой трубке спермии попадают внутрь зародышевого мешка и происходит оплодотворение яйцеклетки. В результате оплодотворения образуется зигота, развивающаяся в зародыш семени. В результате этого процесса образуются плоды с семенами, содержащими наследственность двух растительных организмов. Однако в природе процесс опыления происходит неконтролируемо. В случае же целенаправленной гибридизации селекционер сам подбирает родителей и производит опыление искусственно.
Чтобы произвести искусственное опыление, для начала необходимо собрать пыльцу того растения, которое выбрано в качестве отцовского производителя. Для этого собирают бутоны за два-три дня до распускания, иглой выбирают из них пыльники, подсушивают на бумаге. Созревший пыльник растрескивается и из него высыпается пыльца. Хранят пыльцу в стеклянных флакончиках.
Одновременно с заготовкой пыльцы производят подготовку цветков на растении, которое выбрано в качестве материнского. За два дня до распускания бутонов производят их кастрацию – удаляют все пыльники, чтобы исключить самоопыление цветков и надевают марлевые изоляторы для того, чтобы не допустить к ним пчел, которые могут принести нежелательную пыльцу с других растений. После распускания цветков в изоляторе, производят их опыление – аккуратно наносят пыльцу на рыльце пестика кусочком резинки на медной или алюминиевой проволоке. Произведя опыление, снова одевают марлевый изолятор на ветку.
Обычно через неделю становится ясно, произошло ли оплодотворение. В случае успеха завязывается плод, несущий в себе гибридные семена.
Осенью, после созревания плода, семена выбирают, подсушивают и высевают на подготовленные гряды. Для таких культур как абрикос, слива, вишня производят предварительную подготовку к посеву – стратификацию (выдерживают при температуре +3…+5 0 С в течение одного месяца).
В том случае, если полученные гибридные семена жизнеспособны, на следующий год получают гибридные сеянцы, сочетающие признаки двух родителей.
Другие способы получения материала для селекции
Большинство сортов плодовых и ягодных культур содержат в себе гены множества поколений сортов и гибридов, имеется множество доминирующих признаков, проявляющихся при жизни, а также признаков внешне не видимых, находящихся в подавленном (рецессивном) состоянии. Последние могут проявиться в следующих поколениях, если растение размножается семенным путем. Именно поэтому все сорта плодовых и ягодных культур размножаются только вегетативным путем (клонированием), который позволяет сохранить все хозяйственно-полезные качества. Собственно это будет являться ответом на один из поставленных в начале этой статьи вопросов, а именно, с чем связано сохранение сортовых признаков только при вегетативном размножении.
В редких случаях, правда, происходит и вегетативная изменчивость, получившая в научном мире название «почкового спорта» или клоновой изменчивости. Вегетативная изменчивость происходит в результате мутаций, происходящих в тканях растений. В результате таких мутаций может произойти полное перерождение сорта. Чаще всего клоновая изменчивость проявлятеся в изменении окраски плодов, когда на дереве вдруг проявляется ветвь с плодами совершенно другого цвета.
Селекционеры уже давно научились использовать это явление в своих целях, ведь достаточно размножить мутировавшую ветвь, чтобы получить новый сорт. Известно, что почти все сорта яблок (особенно американского происхождения) с яркой красной окраской являются почковыми мутантами обычных желтоплодных и зеленоплодных сортов.
Для человека мало сведущего в клоновой селекции можно привести пример с картофелем, который, как и плодовые растения, размножается вегетативно (клубнями) и тоже очень сильно подвержен клоновой изменчивости. Если из года в год садить только мелкие клубни этого растения, то произойдет его вырождение. И, наоборот, отбирая для посадки крупные, ровные клубни можно добиться улучшения сорта.
Не редко ученые стимулируют появление мутаций при помощи специальных химических веществ (химический мутагенез) или радиационного облучения (радиационный матагенез), но данные методы занимают незначительное место, по сравнению с традиционным методом получения исходного материала для селекции (гибридизацией).
В любом случае, какой бы метод получения гибридного материала не был использован (гибридизация или мутагенез, клоновый отбор), это всего лишь один из этапов большого и трудоемкого селекционного процесса. Получить гибридный организм это только пол дела, в дальнейшем предстоит вырастить его до плодоношения и провести всестороннее изучение.
Описанный процесс для кого-то может показаться простым, однако его не так просто осуществить, так как не редко на него уходит от двух до пяти лет. Также требуется время для того, чтобы полученные гибридные сеянцы вступили в плодоношение. Что же следует дальше? В чем сложность выведения новых сортов? Сейчас мы в этом и постараемся разобраться.
Рост, рост, рост….
Итак, мы получили гибридные сеянцы, они уже несут в себе гены обоих родителей, однако мы не знаем, насколько много нужных нам признаков они сочетают. Сравнить это можно лишь с ростом ребенка, когда неизвестно, кем он вырастет – инженером, поэтом, ученым или гением, сочетающим в себе множество талантов и умений. Выяснить это можно лишь с годами. Таким образом, чтобы выяснить какими свойствами будет обладать гибридный сеянец нужно дождаться его плодоношения.
Все мы знаем, как долго растут деревья, и как долго нужно ждать того момента, когда деревья приносят первые плоды. Но что касается гибридных сеянцев, то у некоторых культур они растут еще дольше. К примеру, груши и яблони вступают в плодоношение на 8-14 год после посева семян. Есть правда и скороплодные культуры – это смородина, малина, абрикос, которые вступают в плодоношение на второй-третий год после посева.
Длительность вступления в плодоношение связана с необходимостью прохождения ювенильного (юношеского периода), когда растительный организм взрослеет, постепенно приобретает признаки культурности и, наконец, приносит плоды. Если проследить за ростом гибридного сеянца груши, то в начале жизни он будет сильно походить на своих диких предков – у него будут мелкие почки, светлая кора, большое количество колючек. В некоторых случаях эти признаки могут отсутствовать в раннем возрасте, что говорит о хороших потенциальных возможностях гибрида. Часто селекционеры на ранней стадии определяют по этим косвенным признакам, насколько хорошим сочетанием качеств плодов будет обладать тот или иной гибрид. Однако, это не всегда достоверно и приходится ждать вступления в плодоношение сеянцев.
В дальнейшем, по мере роста, из года в год, сеянцы начинают приобретать признаки культурности – у них темнеет кора, почки становятся более крупными, меняется размер и форма листьев, окраска листьев также может стать темнее, количество колючек становится меньше (не редко они исчезают полностью) и, наконец, сеянец вступает в плодоношение.
Здесь хочу сделать небольшое отступление – когда вы захотите приобрести саженцы каких-либо плодовых растений на рынке, у частных продавцов, а иногда и в специализированных питомниках, то сами сможете отличить по указанным мною признакам культурный саженец от дичка, который вам могут «не нарочно» предложить. Данные признаки закрепляются навсегда и передаются из поколения в поколение при вегетативном размножении. Для яблони к культурным признакам можно отнести большую, чем у дичков толщину побегов и их опушенность, а также опушенность листьев – чем она выше, тем больше культурность, выше качества плодов. Что касается ягодных культур, то там признаки культурности на вегетативных частях почти не проявляются и распознать дичок почти не возможно.
Но вернемся к гибридным сеянцам. Первые плоды, которые приносит сеянец, чаще всего не показывают всех своих качеств в первые годы, иногда требуется несколько лет, чтобы стабилизировались признаки вкуса, размера, формы и окраски. Лишь после этого можно судить о достоинствах и недостатках гибрида. В целом, на рост и предварительную селекционную оценку уходит от 8 до 20 лет в зависимости от того, насколько быстро вступает плодовая порода в плодоношение. При этом селекционеру важно получить не менее трех товарных урожаев с одного дерева или куста, чтобы выделить гибрид из общей массы. В идеале на это уходит три года, но очень часто случаются неурожаи по причине нападения вредителей или в особо суровые зимы сеянец оказывается не зимостойким. В этом случае селекционер предпочитает проверить гибрид дополнительно еще в течение двух-трех лет, чтобы исключить попадание малоценных образцов на первичное сортоизучение, которое требует больших материальных затрат и времени.
Давайте представим, что по прошествии нескольких лет, наконец, был выделен гибрид с нужными качествами. Он хорош всем — имеет вкусные и привлекательные плоды, довольно урожаен, не плохо выдержал зимы, да и к вредителям вроде как устойчив. Но как выяснить, будет ли он успешно расти не только на том месте, где вы его посадили, но и в других, отличающихся по микроклиматическим условиям? Насколько лучшим он будет в сравнении с уже существующими (районированными) сортами. Чтобы выяснить это, необходимо перейти к следующему этапу – первичному сортоизучению.
Первичное сортоизучение
Первичное сортоизучение это этап, когда выделенный в результате селекционного отбора гибрид, сравнивается со стандартным (районированным) сортом. Сравнение проводится очень тщательным образом. Как же оно выглядит?
Для начала необходимо вырастить достаточное количество посадочного материала изучаемых новых сортообразцов и стандартных сортов. Для этого их размножают вегетативно. О необходимости вегетативного размножения плодовых культур с целью сохранения я говорил в первой части статьи и здесь подробно на этом вопросе останавливаться не буду. Для сравнительной оценки нового сортообразца необходимо вырастить от 15 до 30 саженцев в зависимости от культуры. Например, чтобы изучить один новый сорт черной смородины, необходимо высадить 30 растений районированного сорта и 30 растений изучаемого. При этом высаживаются они риндомизировано (в разброс) в трех повторениях (по 10 растений в каждом повторении).
После выделения гибрида в селекционном саду, на его размножение и закладку участка первичного сортоизучения обычно уходит 2-3 года. После этого вновь приходится ждать плодоношения, но оно уже наступает быстрее, ведь все высаженные растения являются клонами.
Дождавшись урожая, селекционер проводит сравнение нового сортообразца с районированным по урожайности, зимостойкости, засухоустойчивости, устойчивости к болезням и вредителям, вкусовым и товарным качествам плодов и другим показателям, которые могут оказаться важными. Оценка проводится в течение трех-пяти лет после начала плодоношения, после чего делается вывод о том, по каким именно хозяйственно-ценным признакам данный сортообразец можно рекомендовать в качестве нового сорта, определяется его назначение – столовое, техническое или универсальное. Не редко по результатам первичного сортоизучения новый сортообразец уступает контрольному сорту, и тогда его либо полностью выбраковывают, либо оставляют в коллекции для использования в дальнейшей селекции за отдельные признаки.
Но, допустим, изучаемый нами сортообразец превзошел по многим показателям стандарт. Что дальше? А дальше государственное сортоиспытание.
Государственное сортоиспытание и районирование
Государственное сортоиспытание проводится на специальных участках, где новый сорт сравнивается с районированным или лучшим инорайонным сортом. Схема и продолжительность госсортоиспытания почти полностью совпадает со схемой и продолжительностью первичного сортоизучения. С той лишь разницей, что оно проводится не в селекционном учреждении, а на специальном участке под наблюдением независимого эксперта.
В том случае, если новый сорт выдерживает и это испытание, действительно соответствует всем заявленным требованиям, ему присваивается сортовое название, вносят в государственный реестр селекционных достижений и допускают к использованию на территории субъекта Российской Федерации. Автору сорта выдается авторское свидетельство, а селекционному учреждению патент. После этого сорт считается районированным.
Чаще всего новый сорт может успешно возделываться только в том регионе, где он был выведен. В некоторых случаях такой сорт оказывается достаточно пластичным для того, чтобы выращиваться в условиях другого региона, тогда он получает более широкое распространение.
Изложенные мною этапы создания нового сорта плодового растения позволяют не плохо представить все сложности этого процесса, а самое главное – его продолжительность. И, таким образом, представленная информация позволяет ответить на вопросы, поставленные в предыдущем номере – «почему нельзя вывести сорт груши или яблони с размерами плодов, не уступающим привозным китайским или аргентинским?», «…как выводятся сорта плодовых культур?». Вывести такие сорта можно, но для этого необходимо много лет селекционной работы и больших финансовых затрат. Селекционная работа в Дальневосточном государственном аграрном университете в области плодовых и ягодных культур продолжается непрерывно, непрерывно ведется работа по улучшению сортовых качеств. Ну а каким образом эта работа ведется, мною был дан ответ в полной мере.
Для чего ученые редактируют растения и зачем селекционерам ПЦР-тестирование пшеницы?

О том, каких специалистов ждет аграрный комплекс, зачем ПЦР-тестирование в поле, как готовят современных биотехнологов, генетиков, агрономов и селекционеров, чтобы они могли ответить на глобальные вызовы, мы поговорили с руководителем направления «Биология и биотехнология растений» Университета «Сириус», директором Всероссийского института генетических ресурсов растений имени Н. И. Вавилова (ВИР) Еленой Хлесткиной.
Елена Константиновна, насколько актуальна сегодня селекция в контексте общего развития науки и общества? Для чего в современном мире нужно выводить новые сорта растений, овощей, фруктов, ягод? Ведь в супермаркетах недостатка продуктов нет.
Мы едим картофель, пшеницу, свеклу, не задумываясь над названием сортов. И обращаем на это внимание, только если сами занимаемся огородничеством, выбираем сорт моркови или томатов для выращивания. Между тем происходит постоянная сортосмена, битва за урожай, которая невозможна без совершенствования того, что называется генотипом сорта. Урожайность, вкус, размер плода — на все это влияют окружающая среда, гены.
Если мы вывели сорт пшеницы для Краснодарского края, он ничего не даст в яровом посеве в Сибири или на Алтае. Сорта выводятся для каждого отдельного региона, и даже для отдельных микроклиматических зон. Цель — как можно лучше “состыковать” генотип и окружающую среду для извлечения максимальной урожайности данной культуры в данном регионе. Были периоды селекции, когда требовалось кардинальное усовершенствование генотипов.
Какие это были периоды?
Первым таким ярким периодом было послевоенное время — переход к механизации и химизации в сельскохозяйственном производстве. В ответ на новые требования производства потребовалось перестроить селекционные программы. Потребовалось выводить сорта картофеля с более прочной кожурой, которая не повреждается при механизированной уборке. Еще один пример — рожь, пшеница.
Если вы выйдете в современное зерновое поле, то пшеница будет чуть выше колена, а на картинах XIX века можете видеть людей, идущих по пшеничном полю почти по пояс. Люди не стали великанами —низкорослыми стали сорта зерновых. Раньше отбирали быстро растущие генотипы, чтобы возделываемые растения быстро обгоняли и побеждали сорняки. С применением гербицидов стало возможным выращивать короткостебельные сорта. Они в отличие от высокорослых более устойчивы к полеганию. Это важно, потому что, если пшеница полегла от дождя или ветра, ее уже никаким комбайном не собрать.

Например, появились сорта, из которых можно делать продукцию для функционального и диетического питания без искусственных добавок. При создании сорта можно его генетически “спрограммировать” таким образом, чтобы он мог производить нужное количество витаминов, микроэлементов. Тогда добавки не понадобятся. Еще один тренд, не самый лучший, но появившийся в угоду рынку и в угоду нам, — это транспортабельность и лежкость плодов.
Мы привыкли круглый год покупать клубнику, различные фрукты и овощи, хоть и ворчим, что это все безвкусное и “деревянное”. Как в одном сорте соединить лежкость и отличный вкус? Подчас это невозможно. Сладкая нежная ягода быстро раздавится и испортится. Чтобы решать такие биологически противоречивые задачи, современный селекционер должен обладать арсеналом новых ювелирных методов селекции.
И, конечно, нужны глубокие фундаментальные знания, на которых строятся новые технологии next-generation breeding — селекции следующего поколения. К таким технологиям относится, например, редактирование генома.
Вы говорили, что окружающая среда – один из факторов, под который селекционеры подстраиваются при выведении новых сортов. И меняющийся климат – одна из самых значимых проблем современности. Как эти изменения отражаются в агротехнологиях?
Меняющийся климат — это следующий вызов, да. Климат становится нестабильным, на длинном отрезке времени наблюдается некоторое повышение температуры, но в коротких отрезках времени для сельхозпроизводства страшно не это, а сопутствующая нестабильность погоды.
Зима то слишком теплая, то слишком морозная (хуже, если морозная и без снега). То засуха, то осадки совсем не вовремя. Как быстро приспособить растения? А с учетом, что процесс селекции долгий, еще и надо научиться адаптировать сорта для будущих смоделированных изменений окружающей среды.
Развитие биологической науки, появление методов полногеномного секвенирования, биоинформатика, развитие молекулярной генетики — все это шло какое-то время параллельно селекционному процессу, но сейчас начинает сходиться в одной точке – и очень вовремя с учетом тех вызовов, которые я только что перечислила. Действительно, сегодня требуется комплексное взаимодействие разных специалистов, работа с большими данными, моделирование генотипов будущего на этой основе и создание их ускоренных способом при помощи генетических технологий.
Можно ли сказать, что современная наука позволяет выпускать новые сорта прямиком из лаборатории в производство?
Когда мы говорим про новые методы селекции, отнюдь не имеется в виду, что мы можем забыть старую добрую традиционную селекцию и мечтать, что “сейчас мы тут в лаборатории создадим сорт и сразу передадим в поля”. Ничего подобного. Селекция остается селекцией, и не перенести с поля в лабораторию полностью. Но часть многоэтапного селекционного процесса мы все же можем выполнять вне поля, сокращая, тем самым срок создания сорта.
Например, мы можем проводить отбор по некоторым признакам не в поле, а при помощи ПЦР-тестирования в лаборатории. Или при помощи редактирования генов можно улучшить сорт по некоторым признакам практически за год-два. Но вместе с первым этапом изучения и подбора исходного материала и завершающими полевыми этапами оценки созданного генотипа на создание сорта все равно уйдет 5-6 лет. Новые методы дополняют, а не заменяют прежние подходы.
Например, сейчас в Университете “Сириус” мы ведем трехлетний проект по генетическому редактированию винограда, учимся заменять длительный этап, состоящий из скрещиваний и отбора, более коротким биотехнологическим этапом. При помощи системы редактирования CRISPR/Cas мы хотим изменить несколько генов винограда.
Для чего вы создаете новый сорт? Что даст внедрение новых генов?
Мы внесем изменения, которые повысят устойчивость к двум распространенным заболеваниям — серой гнили и мучнистой росе. Далее полученный материал должен будет проходить размножение, конкурсные испытания, государственную регистрацию, прежде чем станет сортом, который идет в производственные поля. Это первая ласточка. И я хочу сказать, что образовательные модули, которые мы проводим в Университете «Сириус», выстроены по такой же логической цепочке, что и современная селекционная программа.
Первый модуль был посвящен генетике и генетическим ресурсам растений. Студенты получили понимание, откуда берется исходный материал для селекции, как находить гены-мишени, маркирование или редактирование которых позволит ускорять процесс селекции. Такой глубокий пласт фундаментальной науки, который позволяет внедрять достижения в практику. Второй модуль, который проходит сейчас, посвящен технологиям редактирования и/или маркирования генов-мишеней, а также другим приемам разных направлений инженерии растений.
Как раз все те работы, которые ведутся в рамках проекта по винограду — сборка конструкций для редактирования, доставка этих конструкций в клетки растений, проверка эффективности, сейчас изучают студенты в «Сириусе».
То есть молодые ученые с одной стороны знакомятся с технологиями и подходами, с другой стороны – присоединяются к масштабному практикоориентированному проекту?
Да. Ведь если мы будем учить всех работать на модельных растениях, на арабидопсисе (небольшие цветковые растения, относящиеся к капусте и горчице. — Прим. ред.) или сосредоточимся на одной-двух культурах, допустим, на пшенице и картофеле, мы передадим хорошие знания, но их не будет достаточно. Поэтому мы и в лекциях, и в практикумах, и в семинарах затрагиваем несколько разных групп культур, делаем акценты на особенностях работы с ними.
К ним по-разному нужно подходить не только в традиционной селекции и агротехнологиях, но и в инженерных работах. Виды по-разному поддаются культивированию in vitro, у них разные геномы, каждый со своей особенностью. Но главное, что чего мы хотим добиться от выпускников — получая большие — геномные, феномные и прочие “омиксные” — данные, научиться их в конечном счете транслировать в простую и при этом эффективную технологию, которая поможет селекционеру в его ежедневной работе.
Например, какие технологии актуальны для селекционера?
Например, у современного селекционера, кроме поля и теплицы, сейчас, как правило, есть еще и ПЦР-лаборатория. Что такое ПЦР-тестирование из-за пандемии теперь все знают. Если упростить, то это быстрый способ установить, есть у тебя вирус или нет. В случае растений тестирование покажет, несет это растение ген устойчивости к болезни или нет.
Зачем селекционеру именно ПЦР-тестирование устойчивости к болезням растений? Для того, чтобы создать сорт, селекционер через свои руки пропускает десятки тысяч растений. Проводить традиционный фитопатологический скрининг такого числа растений невероятная, неподъемная работа. Но, поставив ПЦР–тест, селекционер быстро определит, какие несколько десятков растений ему надо взять в дальнейшую работу, а остальные — неустойчивые — смело отбросить и не тратить время и средства на их выращивание и оценку.
Для того, чтобы перейти от сложных лабораторных результатов к конкретной технологии, нужно хорошее биологическое мышление, которые мы и хотим студентам помочь сформировать. В магистерском курсе, который мы запускаем со следующего года, подобрано все то, что необходимо будет для подготовки полноценного специалиста с глубоким знанием, с очень хорошим биологическим мышлением, который сможет не просто выполнить краткосрочный проект, опубликовать статью или получить трансформированные растения, измененные по какому-то известному гену, но сможет сам разрабатывать новые технологии и находить новые гены-мишени для практики.

А проект по селекции винограда как сегодня развивается? Откуда брались материалы для экспериментов?
Проектом занимаются исследователи из НТУ «Сириус» в сотрудничестве со Всероссийском институтом генетических ресурсов растений им. Н.И. Вавилова. Также у НТУ достигнута договоренность с ведущим институтом в области традиционной селекции винограда «Магарач» для дальнейшего испытания материала, полученного биотехнологическим путем.
О каком испытании речь?
Отредактированная линия не становится сразу сортом, она должна пройти испытание, такое же, как проходит весь селекционный материал. Без этой апробации дальше ни один сорт не сможет выйти в производство, нужно выявить все достоинства и недостатки. Сейчас уже понятно, что если мы один и тот же ген меняем у одного, у другого, у третьего сорта, эффект на уровне фенотипа может быть разной степени, никто не отменял взаимодействие генов.
Мы сразу взяли в исследование несколько сортов, несколько генов в качестве мишеней, чтобы на выходе иметь несколько линий на разных сортах и чтобы почерпнуть практически полезные знания о том, как взаимодействуют гены. Чем больше комбинаций, тем больше шанс, что получится одна из наиболее эффективных. В этом состоит поисковая часть проекта. Если бы мы заранее знали результат, на каких сортах лучше сработает, то взяли бы только эти сорта и работали”под копирку”, но это был бы уже не научно-исследовательский проект, а просто применение технологии в производстве.
А ген-мишень как удалось определить?
На старте мы активно общались с коллегами, чтобы не просто из литературы взять какой-то ген-мишень и попробовать, а выявить конкретную проблему, актуальную у нас в регионе, где выращивается культура. Очень важно генетикам, биотехнологам, обращаться к селекционерам или производственникам, интересоваться, какие проблемы надо решать. И технологическую цепочку, по которой внедряются в производство сорта, обязательно пройти со специалистами, которые профессионально оценят и дадут характеристики, здесь как раз важна связка с селекционными институтами. По такому принципу выстроен наш проект, таким образом будут выстраиваться следующие проекты.
Вы привлекаете в Университет «Сириус» специалистов для образовательной программы и для реализации таких междисциплинарных проектов. Что нужно, чтобы эти проекты здесь успешно развивались? Как формируется база в рамках лабораторного комплекса университета?
К образовательной программе мы привлекаем специалистов из разных центров и регионов, тех, кто работает с разными культурами, чтобы они помогли сконцентрировать в университете компетенции работы с ними. Инфраструктура тоже нужна комплексная, если вы работаете не только с пшеницей, картофелем.
Даже растильные камеры нужны разные для разных культур, чтобы получить материал для последующей трансформации редактирования, соответственно всю эту информация по крупицам собирали. Так сформировали общий комплект инфраструктуры для биотехнологических работ. В следующем году к нам присоединятся еще 20 магистрантов, мы ожидаем, что они будут работать на разных культурах.
Где еще ваши выпускники, магистранты, могут быть востребованы, кроме проектов НТУ и партнерских институтов, вроде ВИР имени Вавилова?
В любых комплексных программах, которые охватывают больше двух десятков институтов. Только в ВИР в этом году прошли два проекта, в которых задействованы порядка двух десятков институтов, в любой из этих центров нужны такие современные специалисты. Если по душе фундаментальная наука, выпускник устроится в генетический центр искать новые гены-мишени. Если интереснее практическая работа, создание новых генотипов, что, таких выпускников с удовольствием ждут современные селекционные центры.
Наши студенты станут ведущими учеными в селекционной и генетической сфере через 20 лет. Мы готовим специалистов с расчетом на будущее. Мы готовим не просто таких же, кто умеет то, что умеем мы сами, но тех, кто будет менять будущее, придумывать новые и новые технологии. А для этого нужны глубокие фундаментальные знания, умение ими эффективно пользоваться, умение масштабно и нетривиально мыслить.
Вы говорили о том, что курс готовили эксперты из ведущих научных центров страны. Получается, участники этой интенсивной программы в одном месте получают все лучшие компетенции в области агрогенетики?
Да, мы стараемся сделать так, чтобы в одном месте можно было получить сконцентрированные лучшие знания и навыки в этой сфере. К нам приезжают студенты из разных регионов, многие хотят остаться у себя и дальше приносить пользу своей малой родине. Они приезжают к нам на модуль дополнительного образования или поступают в магистратуру «Сириуса», а дальше они возвращаются в свои регионы, чтобы применить знания там. В этом главная идея “Сириуса” — работа на всю страну.
В Научно-технологическом университете «Сириус» стартовал новый образовательный курс, посвященный редактированию геномов растений. Студенты из 15 вузов России приехали в Сириус на две недели, чтобы получить самые актуальные теоретические и практические знания в области инженерии растений.
Источник https://scfh.ru/papers/gmo-i-drugie-geneticheskie-tayny-selektsii-rasteniy/
Источник http://zaritski.ru/kak-vyvodyatsya-novye-sorta-plodovykh-rasteniy
Источник https://xn--80afdrjqf7b.xn--p1ai/news/8924/


