Химический состав клетки — какой он?
Все живые организмы, за исключением вирусов, состоят из клеток. Давайте же разберемся, что это такое и какова ее структура.
Что такое клетка?
Это основная структурная единица живых существ. У нее присутствует собственный обмен веществ. Клетка может существовать и как самостоятельный организм: примером этого являются инфузории, амебы, хламидомонады и т. д. Эта структура состоит из разнообразных веществ, как органических, так и неорганических. Все химические вещества клетки играют определенную функцию в ее строении и обмене.
Химические элементы
В составе клетки насчитывается около 70 различных химических элементов, но основными из них являются кислород, углерод, водород, калий, фосфор, азот, сера, хлор, натрий, магний, кальций, железо, цинк, медь. Первые три представляют собой основу всех органических соединений. Все химические элементы клетки играют определенную роль.
Кислород
Количество этого элемента составляет 65-75 процентов от массы всей клетки. Он входит в состав практически всех органических соединений, а также воды, этим и обусловлено такое высокое его содержание. Этот элемент выполняет очень важную функцию в клетках организмов: кислород служит в качестве окислителя в процессе клеточного дыхания, вследствие которого синтезируется энергия.
Углерод
Данный элемент, как и водород, содержится во всех органических веществах. В химический состав клетки входит его около 15-18 процентов. Углерод в виде СО принимает участие в процессах регуляции клеточных функций, также он в виде СО2 участвует в фотосинтезе.
Водород
Данного элемента в клетке содержится приблизительно 8-10 процентов. Наибольшее его количество находится в молекулах воды. Клетками некоторых бактерий молекулярный водород окисляется для синтеза энергии.

Калий
В химический состав клетки входит около 0,15-0,4 % данного химического элемента. Он выполняет очень важную роль, участвуя в процессах генерации нервного импульса. Вот почему для укрепления нервной системы рекомендуется употреблять препараты с содержанием калия. Также этот элемент способствует поддержанию мембранного потенциала клетки.
Фосфор
Количество этого элемента в составе клетки равно 0,2-1 % от общего ее веса. Он входит в состав молекул АТФ, а также некоторых липидов. Фосфор присутствует в межклеточном веществе и в цитоплазме в виде ионов. Большая его концентрация наблюдается в клетках мышечной и костной ткани. Кроме того, неорганические соединения, включающие этот элемент, используются клеткой для синтеза органических веществ.
Этот элемент входит в химический состав клетки в количестве 2-3 %. Он содержится в белках, нуклеиновых кислотах, аминокислотах и нуклеотидах.
Она входит в состав многих белков, так как содержится в серосодержащих аминокислотах. В малой концентрации присутствует в цитоплазме и межклеточном веществе в виде ионов.
Содержится в количестве 0,05-0,1 %. Поддерживает электронейтральность клетки.
Натрий
Этот элемент присутствует в составе клетки в количестве 0,02-0,03 %. Он выполняет те же функции, что и калий, а также принимает участие в процессах осморегуляции.
Кальций
Количество этого химического элемента составляет 0,04-2 %. Кальций участвует в процессе поддержания мембранного потенциала клетки и экзоцитоза, то есть выделения из нее наружу определенных веществ (гормонов, белков и т. д.)
Магний
В химический состав клетки входит 0,02-0,03 % этого элемента. Он принимает участие в энергетическом обмене и синтезе ДНК, является составляющей ферментов, хлорофилла, содержится в рибосомах и митохондриях.
Железо
Количество этого элемента составляет 0,01-0,015 %. Однако в эритроцитах его гораздо больше, так как он является основой гемоглобина.
Содержится в инсулине, а также во многих ферментах.
Этот элемент является одной из составляющий окислительных ферментов, которые принимают участие в синтезе цитохромов.
Белки
Это самые сложные соединения в клетке, основные вещества, из которых она состоит. Они состоят из аминокислот, соединенных в определенном порядке в цепочку, а потом закрученных в клубок, форма которого специфична для каждого вида белка. Эти вещества выполняют множество важных функций в жизнедеятельности клетки. Одной из самых важных является ферментативная функция. Белки выступают в качестве природных катализаторов, ускоряя процесс химической реакции в сотни тысяч раз — расщепление и синтез каких-либо веществ невозможны без них. Каждый вид ферментов участвует только в одной определенной реакции и не может вступать в другую. Также белки выполняют защитную функцию. Вещества этой группы, охраняющие клетку от попадания в нее чужеродных белков, называются антителами. Эти вещества также защищают от болезнетворных вирусов и бактерий весь организм в целом. Кроме того, эти соединения выполняют транспортную функцию. Она заключается в том, что в мембранах существуют белки-транспортеры, которые переносят наружу или внутрь клетки определенные вещества. Пластическая функция этих веществ также очень важна. Они являются основным строительным материалом, из которого состоит клетка, ее мембраны и органеллы. Иногда белки также осуществляют энергетическую функцию — при недостатке жиров и углеводов клетка расщепляет эти вещества.
Липиды
К этой группе веществ относятся жиры и фосфолипиды. Первые — основной источник энергии. Они также могут накапливаться в качестве запасных веществ на случай голодания организма. Вторые служат основной составляющей клеточных мембран.
Углеводы
Самым распространенным веществом этой группы является глюкоза. Она и подобные ей простые углеводы выполняют энергетическую функцию. Также к углеводам относятся полисахариды, молекулы которых состоят из тысяч объединенных молекул — моносахаридов. Они в основном выполняют структурную роль, входя в состав мембран. Основные полисахариды растительных клеток — это крахмал и целлюлоза, животных — гликоген.
Нуклеиновые кислоты
В эту группу химических соединений входят ДНК, РНК и АТФ.
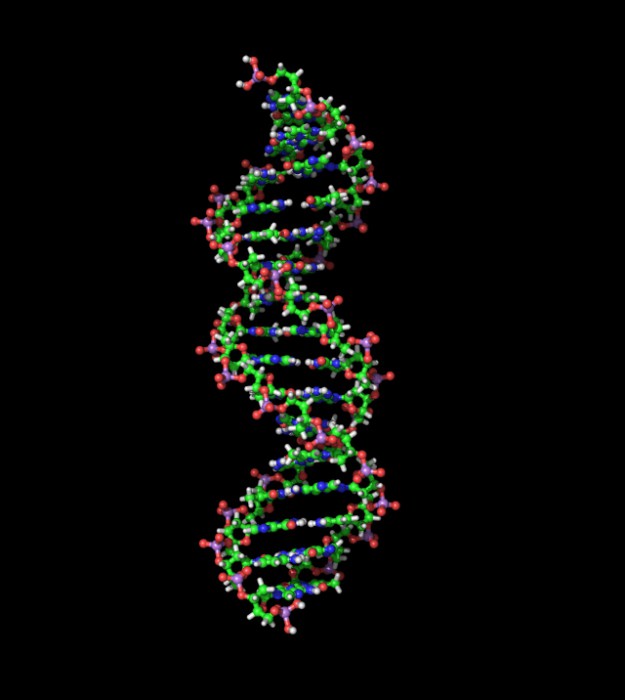
Это вещество выполняет важнейшую функцию — оно отвечает за хранение и наследственную передачу генетической информации. ДНК находится в хромосомах ядра. Макромолекулы этого вещества образуются из нуклеотидов, которые, в свою очередь, состоят из азотистого основания, представленного пуринами и пиримидинами, углеводородом и остатками фосфорной кислоты. Они бывают четырех видов: адениловые, гуаниловые, тимидиловые и цитидиловые. Название нуклеотида зависит от того, какие пурины входят в его состав, это может быть аденин, гуанин, тимин и цитозин. Молекула ДНК имеет форму двух цепочек, закрученных в спираль.
Данное соединение выполняет функцию реализации информации, которая находится в ДНК, через синтез белков, состав которых зашифрован. Это вещество очень похоже на описанную выше нуклеиновую кислоту. Основным их отличием является то, что РНК состоит из одной цепочки, а не двух. Также в состав нуклеотидов РНК входит азотистое основание урацил вместо тимина и рибоза. Поэтому данное вещество формируется из таких нуклеотидов, как адениловый, гуаниловый, уридиловый и цитидиловый.
Любая энергия, полученная растительными клетками в процессе фотосинтеза или животными вследствие окисления жиров и углеводов, запасается в конечном счете в АТФ, из которой клетка получает ее, когда это нужно.
XIII Международная студенческая научная конференция Студенческий научный форум — 2021

Высшей степенью развития вещества в природе, обусловившей появление жизни, являются высокомолекулярные соединения – белки. Жизнь и белок – понятия взаимосвязанные.
Жизнь представляет собой переплетение сложнейших химических процессов, в которых белки взаимодействуют между собой и с другими веществами.
Белок – неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Необходимость постоянного получения белковой пищи человеком вызвано наличием у белка определённых функций, которые необходимы живому организму для его развития, размножения и осуществления жизнедеятельности.
На долю белка приходится не менее 50% сухой массы органических соединений животной клетки. В каждой клетке находится более 3 000 молекул белков. В организме человека насчитывается свыше 10 млн. белков.
Функционирование белка лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифичных катализаторов биохимических реакций, являющихся белками.
Основу костной и соединительной тканей, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, работа мышц осуществляются по единому механизму при посредстве белков сократительной системы.
Белки защищают организм от инфекции. Контакты клетки с внешней средой выполняют разнообразные белки, умеющие различать форму молекул, регистрировать температурные изменения, ничтожные примеси веществ, отличать один цвет от другого.
Важную группу составляют регуляторные белки, контролирующие биосинтез белка, и нуклеиновых кислот.
Биохимический синтез белка в промышленных целях однозначно важен для человечества, это позволяет создавать искусственные препараты, продукты питания и средства индивидуальной защиты.
Всё это определяет актуальность темы данного проекта.
Целью данной работы является изучение влияния белков на состояние здоровья человека. Исходя из цели, были поставлены следующие задачи:
1. Изучить состав, классификацию и функции белков.
2. Проанализировать содержание белков в продуктах питания.
3. Выявить влияние обмена белков в организме на состояние здоровья человека.
Объект: белки.
Предмет: влияние белков на состояние здоровья человека.
Вид проекта: информационный.
Методы исследования: анализ, систематизация, изучение, обобщение.
Белки, их состав, классификация и функции
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков -аминокислот, связанных между собой пептидными связями. Название протеины (от греческого proteos — первый, важнейший) отражает первостепенное значение этого класса веществ.
Рассмотрим химический состав белков. Несмотря на различие в строении и функциях белковых веществ, их элементный состав колеблется незначительно (в % на сухую массу): 51-53 % углерода, 15-18 % азота, 21,5-23,5 % кислорода, 6,5-7,3 % водорода, 0,3-2,5% серы. Кроме перечисленных основных компонентов, в состав некоторых белков входят фосфор, железо, йод, селен, медь и некоторые другие элементы. Для большинства белков характерна довольно постоянная доля азота (в среднем 16 %) по сравнению с другими элементами. Этот показатель используют для расчёта количественного содержания белка.
Белки представляют собой полимерные молекулы, в состав которых входит 20 различных -аминокислот. Поскольку эти аминокислоты могут объединяться в самой различной последовательности, то они могут образовывать громадное количество разнообразных белков и их изомеров.
По биологическому значению аминокислоты подразделяются на заменимые, полузаменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве. К ним относятся: глицин, аланин, серин, цистеин, пролин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин.
Полузаменимые аминокислоты образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполняться белковой пищей. Для организма человека такими аминокислотами являются тирозин, аргинин, гистидин.
Незаменимые аминокислоты в организме человека не синтезируются, поэтому они должны поступать с пищей. Незаменимых аминокислот восемь: лейцин, метионин, изолейцин, лизин, фенилаланин, триптофан, треонин и валин.
Аминокислотный состав белков определяется не доступностью или незаменимостью той или иной аминокислоты, а назначением белка, его биологической функцией.
Перейдём к классификации белков.
Ввиду огромного числа белков, функционирующих в живых организмах, не существует единой их классификации. В настоящий момент действует несколько классификаций; в основу каждой из них положен какой-либо признак, по которому белки объединяют в узкие или широкие группы.
По степени сложности строения белки делят на простые и сложные. Простые или однокомпонентные белки состоят только из белковой части и при гидролизе дают аминокислоты. К сложным или двухкомпонентным относят белки, в состав которых входит протеин и добавочная группа небелковой природы, называемая простетической. В качестве простетической группы могут выступать липиды, углеводы, нуклеиновые кислоты; соответственно сложные белки называют липопротеинами, гликопротеинами, нуклеопротеинами.
По форме белковой молекулы белки разделяют на две группы: фибриллярные (волокнистые) и глобулярные (корпускулярные).
По отношению к условно выбранным растворителям выделяют альбумины и глобулины. Альбумины очень хорошо растворяются в воде и в концентрированных солевых растворах. Глобулины не растворяются в воде и растворах солей умеренной концентрации.
По источнику получения белки подразделяют на животные, растительные и бактериальные.
В зависимости от наличия в составе белка незаменимых аминокислот, а также от степени его усвоения организмом, белок делится на полноценный и неполноценный.
Наиболее удовлетворительной является функциональная классификация белков, поскольку в её основу положен не случайный признак, а выполняемая функция.
Каталитически активные белки – ферменты. Они осуществляют катализ практически всех химических превращений в клетке.
Гормоны регулируют обмен веществ внутри клеток и интегрируют обмен в различных клетках организма в целом.
Рецепторы избирательно связывают различные регуляторы (гормоны, медиаторы) на поверхности клеточных мембран.
Транспортные белки осуществляют связывание и транспорт веществ между тканями и через мембраны клетки.
Структурные белки участвуют в построении, прежде всего, различных биологических мембран.
Белки – ингибиторы ферментов осуществляют регуляцию активности ферментов.
Сократительные белки обеспечивают механический процесс сокращения с использованием химической энергии.
Защитные белки – антитела защищают организм от воздействия чужеродных соединений, вирусов, бактерий и т. д.
Приведённые выше классы не исчерпывают перечень белков по функциональной классификации.
Белкам принадлежит особая роль в воспроизводстве основных структурных элементов клетки.
Наследственная информация сосредоточена в молекуле ДНК клеток любых живых организмов, поэтому с помощью белков реализуется генетическая информация. Без белков и ферментов ДНК не может реплицироваться, самовоспроизводиться. Таким образом, белки являются основой структуры и функций живых организмов.
Охарактеризуем основные функции белков:
1. Строительная функция – белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран, волос, сухожилий, стенок сосудов и т.д.
2. Транспортная – некоторые белки способны присоединять к себе различные вещества и переносить (доставлять) их из одного места клетки в другое, и к различным тканям и органам тела. Белок крови гемоглобин присоединяет кислород и транспортирует его от лёгких ко всем тканям и органам, а от них в лёгкие переносит углекислый газ. В состав клеточных мембран входят особые белки, обеспечивающие активный и строго избирательный перенос некоторых веществ и ионов из клетки и в клетку – осуществляется обмен с внешней средой.
3. Регуляторная функция – принимают участие в регуляции обмена веществ. Гормоны влияют на активность ферментов, замедляя или ускоряя обменные процессы, изменяют проницаемость клеточных мембран, поддерживают постоянство концентрации веществ в крови и клетках, участвуют в процессе роста. Гормон инсулин регулирует уровень сахара в крови путём повышения проницаемости клеточных мембран для глюкозы, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
4. Защитная функция – иммунологическая. В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки – антитела, способные связывать и обезвреживать их. Синтез иммуно-глобулинов происходит в лимфоцитах. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
5. Двигательная функция – сократительные белки актин, миозин, тропонины, тропомиозин участвуют в работе мышц.
6. Сигнальная функция – в поверхностную мембрану клетки встроены молекулы белков, способные изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит приём сигналов из внешней среды и передача команд в клетку.
7. Запасающая функция – в организме могут откладываться про запас некоторые вещества. Например, при распаде гемоглобина железо не выводится из организма, а сохраняется в селезёнке, образуя комплекс с белком ферритином.
8. Энергетическая функция – при распаде 1 г белка до конечных продуктов выде
ляется 17,6 кДж (4,1 ккал) энергии. Распад идёт сначала до аминокислот, а потом – до воды, аммиака и углекислого газа. Однако в качестве источника энергии белки используются тогда, когда израсходованы жиры и углеводы.
9. Каталитическая функция – ускорение биохимических реакций под действием белков-ферментов.
10. Трофическая функция – питают зародыш на ранних стадиях развития и запасают биологически ценные вещества и ионы.
Содержание белков в продуктах питания
Все пищевые продукты различаются как по содержанию, так и по аминокислотному составу протеинов. Аминокислотный состав белков в продуктах питания имеет большое значение, т.к. ряд аминокислот являются незаменимыми.
При этом большое значение имеет не просто наличие тех или иных незаменимых аминокислот, а ещё и их определённые пропорции. Полноценными считаются белки, включающие в состав восемь незаменимых аминокислот.
Причём продукты, содержащие эти белки, не могут быть заменены продуктами, содержащими жиры и углеводы.
В питательном отношении растительные белки менее ценны, чем животные; они беднее лизином, метионином и триптофаном, труднее перевариваются.
В наибольшем количестве белки и незаменимые аминокислоты представлены в следующих продуктах питания: молоко, молочные изделия, яйца, мясо и мясопродукты, рыба, морепродукты, бобовые (горох, чечевица, фасоль, соя), крупы, хлеб, картофель и др.
Первая группа – молочные продукты. Именно молоко почти полностью обеспечивает потребности не только детского, но и взрослого организма. В 100 г молока содержится 3 г белка. Пол-литра молока в день — это более половины суточной потребности человека в животном белке. Белки молока содержат все аминокислоты и в наилучшем соотношении, необходимом организму. В молочных белках содержатся в значительных количествах метионин – аминокислота, важная для обеспечения нормальной деятельности печени. Таким образом, в молоке и молочных продуктах весьма удачно сочетаются полноценные белки.
Вторая группа – мясо, рыба, яйца. Изучение аминокислотного состава различных продуктов показало, что степень усвоения мясных продуктов очень высока. Биологическая ценность белков рыбы не ниже, поскольку их аминокислотные составы весьма близки. Установлено, что белки рыбы и многих продуктов моря даже несколько легче перевариваются и усваиваются в организме человека, чем белки мяса. Весьма ценным и питательным продуктом являются яйца, в них содержатся лучшие по аминокислотному составу белки. Мясо, несомненно, очень полезный продукт благодаря высокому содержанию полноценного животного белка – в различных сортах мяса и птицы содержится от 14 до 24% белка.
Третья группа – мука, хлебобулочные изделия, крупы, макаронные изделия. Основное значение продуктов этой группы, содержащих большое количество углеводов, – снабжение организма энергией. Содержащиеся в них растительные белки удовлетворяют общую потребность человека в белках примерно на 30 — 35%.
Белки животного происхождения, как правило, содержат все незаменимые аминокислоты, а белки растительного происхождения часто некоторые из этих аминокислот или не содержат вовсе, или содержат, но слишком мало. Поэтому белок животного происхождения усваивается организмом полностью, а усвояемость белков растительного происхождения несколько ниже. Степень усвояемости белков из пищи зависит, кроме их аминокислотной сбалансированности, и от перевариваемости. Белки животного происхождения перевариваются практически на 100%, а белки растительного происхождения – на 75-85%.
Отдельно следует сказать о белках сои, которые всё более широко внедряются в повседневное питание населения многих экономически развитых стран. Они представлены соевой мукой (содержание белка около 50%), соевым концентратом (содержание белка около 70%) и соевым изолятом (содержание белка не ниже 90%). По аминокислотному составу белки сои близки к белкам мяса, и поэтому в народе их называют растительным «мясом».
Белки поступают в организм человека с различными пищевыми продуктами, в которых содержание белка колеблется в широких пределах. Приведём таблицу, дающую представление о содержании белка в некоторых продуктах питания (табл. 1).
Рибосома – минифабрика по производству белков
Одним из наиболее сложных процессов, осуществляемых живыми существами, является, пожалуй, синтез белков — важнейших структурных и функциональных «кирпичиков» любого организма. Подлинное понимание молекулярных процессов, лежащих в его основе, могло бы пролить свет на неимоверно давние события, связанные с тайной зарождения самой Жизни.
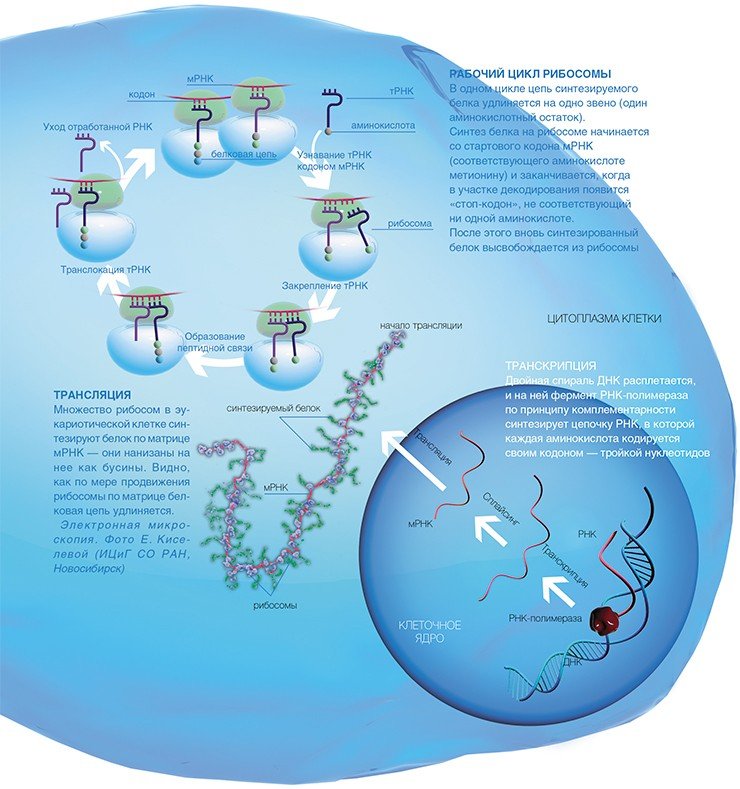
Во всех живых организмах, от простейших бактерий до человека, белки синтезируются специальными клеточными устройствами рибосомами. На этих уникальных фабриках происходит образование белковой цепи из отдельных аминокислот.
В клетках, ведущих интенсивный белковый синтез, рибосом очень много: так, в одной бактериальной клетке содержится около 10 тыс. этих минифабрик, составляющих до 30% общей сухой массы клетки! В клетках высших организмов рибосом содержится меньше — их число зависит от типа ткани и уровня метаболизма клетки.
Рибосома синтезирует белок со средней скоростью 10—20 аминокислот в секунду. Точность трансляции исключительно высока — ошибочное включение «неправильного» аминокислотного остатка в цепь белка составляет в среднем одну аминокислоту на 3 тыс. звеньев (при средней длине белковой цепи у человека в 500 аминокислотных остатков), т. е. всего одна ошибка на шесть белков.
О генетическом коде
Программа, задающая последовательность аминокислотных остатков в белке, записана в геноме клетки: около полувека назад было установлено, что аминокислотные последовательности всех белков непосредственно закодированы в ДНК с помощью так называемого генетического кода. Согласно этому коду, универсальному для всех живых организмов, каждой из двадцати существующих аминокислот соответствует свой кодон — тройка нуклеотидов, представляющих собой элементарные единицы цепочки ДНК. Любой белок закодирован в ДНК определенной последовательностью кодонов. Эта последовательность называется геном.
Одна клетка может содержать до 10 тыс. рибосом — белковых минифабрик, составляющих до 30% сухой клеточной массы
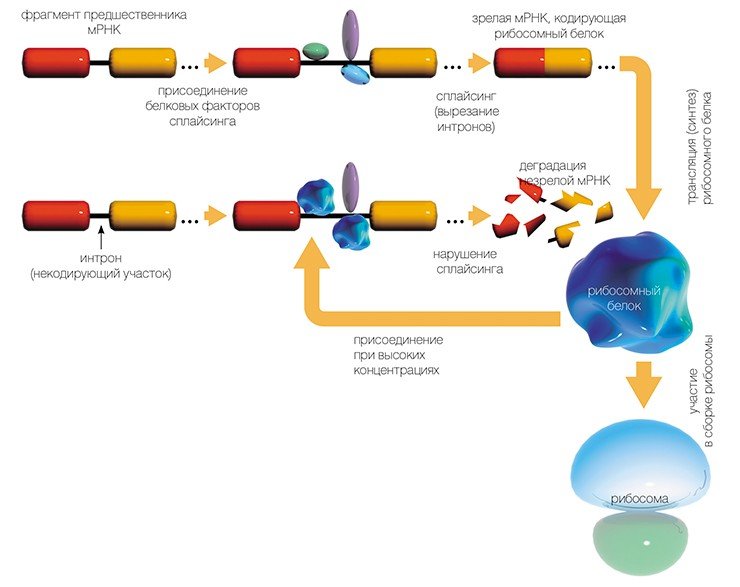
Как же эта генетическая информация доходит до рибосомы? На отдельном гене, как на матрице, синтезируется цепь еще одной информационной молекулы — рибонуклеиновой кислоты (РНК). Этот процесс копирования гена, называемый транскрипцией, осуществляется специальными ферментами — РНК-полимеразами.
Но РНК, полученная таким образом, еще не является матрицей для синтеза белка: из нее, вырезаются определенные «некодирующие» куски нуклеотидной последовательности (процесс сплайсинга).
Точность белкового синтеза рибосомой исключительно высока — у человека ошибка составляет один на три тысячи «неправильный» аминокислотный остаток
В результате получается матричная РНК (мРНК), которая и используется рибосомами в качестве программы для синтеза белка. Сам синтез, т.е. перевод генетической информации с языка нуклеотидной последовательности мРНК на язык аминокислотной последовательности белка, называется трансляцией.
Декодирование и синтез
В клетках эукариот одну мРНК обычно транслирует сразу множество рибосом, образуя так называемые полисомы, которые можно отчетливо видеть с помощью электронной микроскопии, позволяющей получать увеличение в десятки тысяч раз.

Как поступают в рибосому аминокислоты, являющиеся строительными кирпичиками для синтеза белка? Еще в 50-х годах прошлого столетия были открыты особые «перевозчики», доставляющие аминокислоты в рибосому, — короткие (длиной менее 80 нуклеотидов) транспортные РНК (тРНК). Специальный фермент присоединяет аминокислоту к одному из концов тРНК, причем каждой аминокислоте соответствует строго определенная тРНК. Синтез белка на рибосоме включает три основные стадии: начало, удлинение полипептидной цепи и окончание.
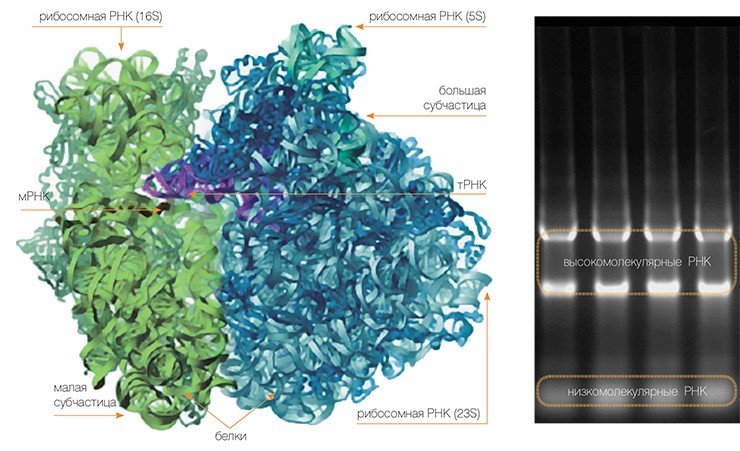
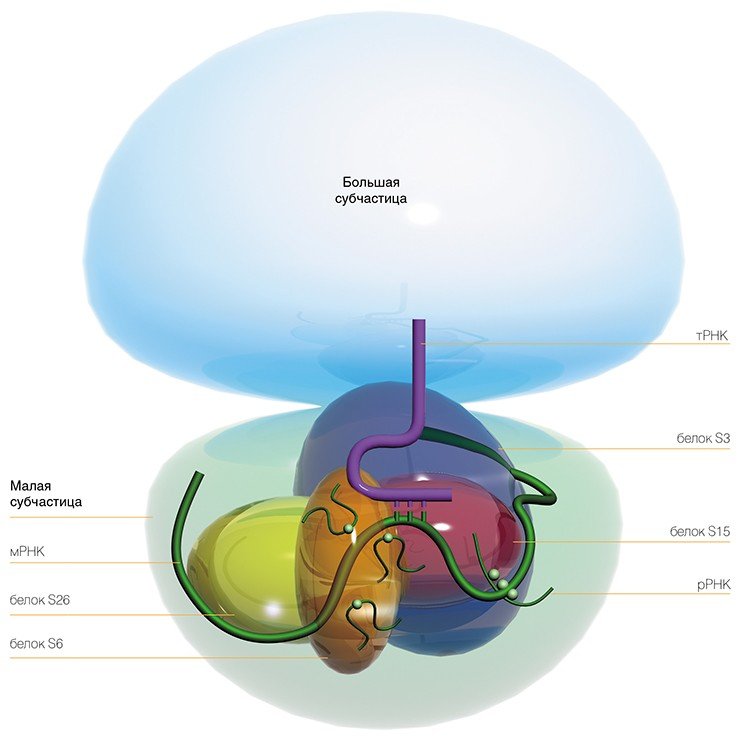
Сама рибосома — одна из самых сложно организованных молекулярных машин клетки — состоит из двух неравных частей, так называемых субчастиц (малой и большой). Ее можно легко разделить на части центрифугированием при сверхвысоких скоростях в специальных пробирках с раствором сахарозы, концентрация которой увеличивается сверху вниз. Поскольку малая субчастица в два раза легче большой, они движутся от верха пробирки к дну с разными скоростями.
Малая субчастица отвечает за декодирование генетической информации. Она состоит из высокомолекулярной рибосомной РНК (рРНК) и нескольких десятков белков (около 20 у прокариот и более 30 — у эукариот).
В раковых клетках резко повышается уровень некоторых рибосомных белков. Возможная причина — сбои в механизмах авторегуляции их производства
Большая субчастица, ответственная за образование пептидной связи между аминокислотными остатками, состоит из нескольких рРНК: одной высокомолекулярной и одной (или двух в случае эукариот) низкомолекулярной, а также нескольких десятков белков (более 30 у прокариот и до 50 у эукариот). О масштабе деятельности рибосом можно судить хотя бы по тому факту, что рибосомная РНК составляет около 80 % всей РНК клетки, тРНК, транспортирующая аминокислоты, — около 15 %, тогда как матричная РНК, несущая информацию о белковой последовательности, — лишь 5 %!
Нужно отметить, что рибосомные белки наделены множеством других, дополнительных функций, которые могут проявляться на разных этапах жизнедеятельности клетки. Например, рибосомный белок S3 человека — один из ключевых белков центра связывания мРНК на рибосоме — принимает также участие в «ремонте» повреждений в ДНК (Kim et al., 1995), участвует в апоптозе (запрограммированной гибели клетки) (Jung et al., 2004), а также защищает от разрушения белок теплового шока (Kim et al., 2006).
Кроме того, чересчур интенсивный синтез некоторых рибосомных белков может свидетельствовать о развитии злокачественной трансформации клетки. Например, значительное повышение уровня пяти рибосомных белков было обнаружено в опухолевых клетках толстого кишечника (Zhang et al., 1999). Недавно сотрудниками лаборатории структуры и функции рибосом ИХБФМ СО РАН был открыт новый механизм авторегуляции биосинтеза рибосомных белков у человека, основанный на принципе обратной связи. Неуправляемый синтез рибосомных белков, характерный для опухолевых клеток, вероятно, вызван сбоями именно в этом механизме. Дальнейшие исследования в этой области представляют особый инте¬рес не только для ученых, но и для медиков.
Работает как «рибозим»
Удивительно, но, несмотря на миллиарды лет эволюции, разделяющие бактерии и человека, вторичная структура рибосомальных РНК у них мало различается.
О том, как уложена рРНК в субчастицах и каким образом она взаимодействует с рибосомными белками, до недавнего времени было известно не много. Революционный сдвиг в понимании устройства рибосомы на молекулярном уровне произошел на рубеже нового тысячелетия, когда с помощью рентгеноструктурного анализа удалось расшифровать на уровне отдельных атомов структуру рибосом простейших организмов и их модельных комплексов с мРНК и тРНК. Это позволило понять молекулярные механизмы декодирования генетической информации и образования связей в молекуле белка.
Оказалось, что оба важнейших функциональных центра рибосомы — как декодирующий на малой субчастице, так и отвечающий за синтез белковой цепочки на большой субчастице — сформированы не белками, а рибосомной РНК. То есть, рибосома работает подобно рибозимам — необычным ферментам, состоящим не из белков, а из РНК.
Рибосомные белки, тем не менее, также играют важную роль в работе рибосомы. В отсутствие этих белков рибосомные РНК совершенно неспособны ни декодировать генетическую информацию, ни катализировать образование пептидных связей. Белки обеспечивают необходимую для работы рибосомы сложную «укладку» рРНК в функциональных центрах, служат «передатчиками» изменений пространственной структуры рибосомы, необходимых в процессе работы, а также связывают различные молекулы, влияющие на скорость и точность процесса белкового синтеза.
Сама рабочая схема белкового цикла в принципе одинакова для рибосом всех живых существ. Однако до сих пор неизвестно, до какой степени схожи молекулярные механизмы работы рибосом у разных организмов. Особенно не хватает информации об устройстве функциональных центров рибосом высших организмов, которые изучены гораздо хуже, чем рибосомы простейших.
Это связано с тем, что многие из методов, успешно использованных для исследования рибосом прокариот, оказались для эукариот неприменимыми. Так, из рибосом высших организмов не удается получить кристаллы, пригодные для рентгеноструктурного анализа, а их субчастицы невозможно «собрать» в пробирке из смеси рибосомных белков и рРНК, как это делается у простейших.
От низших — к высшим
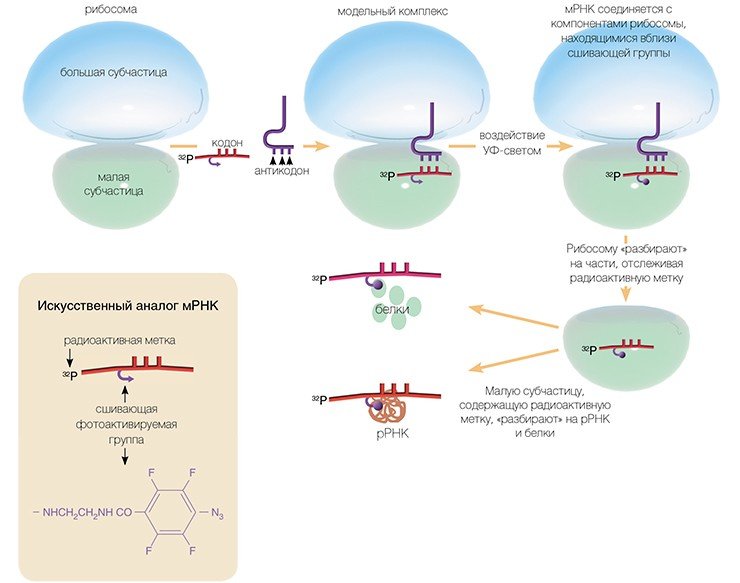
И все-таки способы получения сведений о строении функциональных центров рибосом высших организмов существуют. Одним из таких методов является метод химического аффинного сшивания, разработанный 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.
Метод основан на использовании коротких синтетических мРНК, несущих в выбранном положении химически активные («сшивающие») группы, которые в нужный момент можно активировать (например, облучая мягким ультрафиолетовым светом).
Метод аффинного химического сшивания был разработан 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.До появления рентгеноструктурного анализа рибосом он использовался во всем мире для изучения рибосом у прокариот.
Этот метод и сегодня является основным для изучения структурно-функциональной организации рибосом высших организмов
Достоинство этого метода в том, что сшивающую группу можно присоединить практически к любому нуклеотидному остатку мРНК и в результате получить детальную информацию о его окружении на рибосоме. Используя набор коротких мРНК с разным расположением сшивающей группы, нам удалось определить рибосомные белки и нуклеотиды рРНК рибосомы человека, образующие канал для считывания генетической информации в процессе трансляции.
Впервые экспериментально удалось показать, что все нуклеотиды рРНК малой рибосомной частицы человека, соседствующие с кодонами мРНК, расположены в консервативных районах вторичной структуры молекулы рРНК. Более того, их расположение совпадает с положением соответствующих нуклеотидов во вторичной структуре рРНК рибосом низших организмов. Это позволило сделать вывод, что эта часть рибосомной РНК малой субчастицы составляет эволюционно консервативный «кор» (сердцевину) рибосомы, структурно идентичный у всех организмов.
С другой стороны, в устройстве мРНК-связывающего канала рибосом у человека и низших организмов обнаружен ряд принципиальных различий. Оказалось, что у высших организмов рибосомные белки играют намного большую роль в формировании этого канала, чем у прокариот, кроме того, в этом участвуют также белки, не имеющие «двойников» (гомологов) у низших организмов.
Почему же, несмотря на то, что функция рибосомы практически не изменилась в процессе эволюции, в организации декодирующего центра рибосом у высших организмов появились специфичные черты? Вероятно, это связано с более сложной и многостадийной регуляцией белкового синтеза у эукариот по сравнению с прокариотами, в ходе которой рибосомные белки мРНК-связывающего канала могут взаимодействовать не только с мРНК, но и с различными факторами, влияющими на эффективность и точность трансляции. Так ли это, покажут дальнейшие исследования.
Источник https://www.syl.ru/article/140705/mod_himicheskiy-sostav-kletki—kakoy-on
Источник https://scienceforum.ru/2021/article/2018027286
Источник https://scfh.ru/papers/ribosoma-minifabrika-po-proizvodstvu-belkov/





